
使用自体骨块引导骨再生进行牙槽嵴增量:一项10年前瞻性病例系列研究

文献摘要
目的:本研究的目的是分析牙槽嵴增加10年种植体的成功率和植骨的吸收率,以阐明影响植骨维持的因素。
材料和方法:使用DBBM和胶原膜保护的自体植骨块,对52个水平骨萎缩严重的种植位点进行分期水平自体骨增量。在术中和6个月后重新打开受植区时评估增量的牙槽嵴宽度。在10年复查时,使用锥形束计算机断层扫描评估临床和影像学参数。
结论:应用自体骨块植骨引导骨再生技术行水平骨增量术的10年随访成功率为98.1%,移植骨块吸收量为7.7%。影响植骨成功率的因素有植骨来源和性别。
文献简介
创伤或疾病导致的牙槽突大段骨缺损的修复是口腔种植学的一大挑战。尽管种植修复技术不断进步,但仍需要足够的骨体积植入种植体,还要以修复为导向放置种植体,这是长期维持骨整合和实现美观的重要先决条件。系统分析了在骨量缺失的受体部位骨增量的各种手术技术。这些评论表明,引导骨再生(GBR)是一种有充分证据的外科技术,可预测地促进新骨形成进入骨缺损。GBR技术既可以与植入物同时应用,也可以在植入物放置之前应用,称为同期植入或延期植入。对于两种适应证,第一种是不能正确进行以修复导向种植,第二种是可以明确观察到植入物的愈合情况,并选定时间进行种植,会需要更长的治疗周期,但可以以修复为导向进行种植体植入。水平萎缩导致骨外不利的一壁缺损形态。
在口腔颌面外科中,应用口内自体下颌升支或下颌升支植骨是一种有效的分期手术方案。在这些特定的适应证中,自体骨移植仍然是金标准,因此是大多数临床医生的首选。自体骨块具有成骨和骨诱导的特性,提供细胞和生物活性分子,如骨形态发生蛋白,以诱导新骨形成,使移植物彻底融入受植区。然而,自体骨块移植有三个重要的缺点。第一,由骨采集部位引起的并发症增加。其次,与最初增量后的移植物体积相比,吸收率达(18-60%)。最后分析了阶段性治疗方案后植入牙种植体的成功率,而且还计算了随着时间的推移,增量的骨体积的保存情况。
减少种植体周围的骨吸收是成功修复种植体的关键。自体骨块移植和生物屏障膜的结合在20世纪90年代初首次被使用。将自体骨块移植物与生物屏障膜相结合的主要目的是避免愈合期间膜塌陷,并保护应用的自体骨移植物不被吸收。前瞻性病例系列研究证实,在6个月愈合期间,采用生物屏障膜移植物吸收会减少,5年随访结果表示移植物稳定。脱蛋白牛骨矿物颗粒(DBBM)也可获得抗骨吸收的移植物保护,替代率低,使愈合6个月后移植物吸收减少。24在21世纪初,临床医生开始将自体骨块移植物与DBBM和非交联胶原膜(CM)联合使用。这种技术简化了手术过程,因为胶原膜方便术中处理,潜在的减少术后并发症。此外,增加的骨体积揭示了种植体植入时有限的骨吸收率。
本前瞻性病例系列研究的主要目的是分析采用DBBM和胶原膜保护的自体骨块,进行分阶段种植手术后种植体的成功和移植物的维持。次要目的是阐明在10年随访期间可能影响这些骨块骨吸收的因素。
材料和方法
研究人群
为期10年的研究方案获得了伯尔尼州伦理委员会的批准(方案编号245/12)。本研究是根据《赫尔辛基宣言》的原则进行。目前的研究是一项前瞻性临床试验的延续,该试验分析了使用DBBM颗粒和胶原膜的保护性自体骨块在愈合6个月后的结果。主要纳入标准为水平面上牙槽嵴重度萎缩(4 mm),或微笑线高的美学位点牙槽嵴宽度5 mm。术前分析包括完整的病史、口颌系统的临床和影像学检查以及对种植体受区进行全面的分析。
外科手术

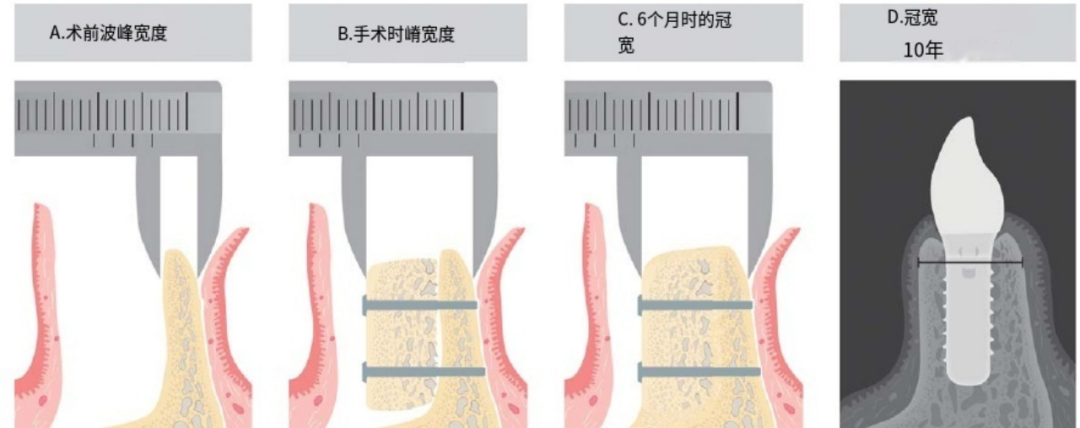
图1 (A)完整的翻开黏骨膜瓣,剩余的嵴宽度用一对卡尺测量(术前嵴宽度)。(B)骨块适配受体缺损部位,并通过一或两颗螺钉固定,以稳定骨块。再次测量增量的牙槽嵴嵴宽度(手术时的牙槽嵴宽度)。(C) 6个月复诊时,再次测量愈合的骨嵴宽度(6个月时的骨嵴宽度)。(D) 10年复查时,使用锥形束ct (3D Accuitomo 170,森田,京都,日本)分析牙槽嵴宽度。
在受植部位准备时,先完整翻起颊侧黏骨膜瓣,用之前描述的一对卡尺测量剩余的嵴宽度(图1A,术前嵴宽度)。根据所需的骨块的大小和供区解剖,骨块移植物从颏部或从磨牙后区收获。从颏部切取骨块时,考虑了下切牙根尖以下5 mm的最小安全区,以最大限度地减少神经感觉障碍,供区创面一期闭合后,将植骨块与受区缺损区形态相适应,并通过1枚或2枚螺钉固定以稳定植骨块。用卡尺再次测量增加的牙槽嵴宽度(图1B,手术时的牙槽嵴宽度)。用自体骨骨屑填充植骨块周围的空隙。DBBM颗粒(Bio-Oss, Geist-lich AG, Wolhusen, Switzerland)与从手术部位获得的血液混合,并完全覆盖增强部位。此外,增强部位胶原膜(Bio-Gide, Geistlich AG, Wolhusen,瑞士)采用双层技术进一步保护。使用不可吸收的聚酰胺缝线(Seralon, Serag-Wiessner GmbH, Naila,德国),做一个骨膜松解切口,以允许皮瓣游离和无张力的一期伤口闭合。供区伤口使用可吸收缝线闭合(Vicryl, Ethicon, Sommer-ville, NJ, USA)。术前1 h给予2 g克拉维酸阿莫西林,术后晚、早各1g,连续3 d。然而,在第3天出现血肿形成的患者延长了抗生素用药时间。术后14天左右拆线,我们采用了可拆卸的临时义齿,但告知患者谨慎佩戴。
6个月时再手术打开植骨区域,用卡尺再次测量愈合的骨嵴宽度(图1C, 6个月时的骨嵴宽度)。拆除骨块固定螺钉,按照标准手术方案完成植入(Straumann AG, Basel,瑞士)。3 ~ 6个月愈合后,采用单冠或桥体的方式固定修复种植体。
10年后临床随访检查
10年随访检查包括口内照相、临床和影像学检查。我们通过问卷和患者病历收集了与疾病、吸烟史、自我报告的生物和技术并发症以及是否参与维持治疗计划相关的信息。
本报告中测量的临床参数与描述相同,种植体周围化脓,改良菌斑指数(mPLI),改良龈沟出血指数(mSBI),探诊深度(PD, mm),以及种植体颈部与黏膜边缘的距离(DIM, mm)。测量4个位点(近中、远中、颊侧和口腔)的临床参数,并计算4个位点的中位数和平均值。
10年后使用2D x线片和3D CBCT进行放射学分析
在根尖周x线片上测量种植体周围骨吸收,分析近端DIB值作为从种植体颈部到第一次骨-种植体接触的垂直距离。38计算近中远中dib值的平均值。38采用4 ~ 4 cm的三维CBCT检查骨嵴宽度,分析骨嵴尺寸(3D Accuitomo 170,森田,京都,日本)。采用专用软件(i-Dixel,森田,京都,日本)进行高分辨率屏幕CBCT分析。波峰宽度为分析了种植体颈部水平4 mm以下(图1D, 10年愈合时的牙槽嵴宽度)。
统计分析
首先对所有数据集进行描述性分析,并表示为中位数和平均值(标准误6)。两两比较采用精确的wilcoxon Mann-Whitney U检验。在析因实验中,采用Brunner-Langer模型-el进行非参数方差分析,以确定随访期间临床和影像学数据的统计学意义。39对于时间和/或组效应,包括它们的交互作用,我们计算了方差分析类型统计的P值。p值小于0.05(*)被认为具有统计学意义。所有统计分析均使用开源R软件包(R 3.2.2, R foundation for statistical Computing,维也纳,奥地利)进行计算。
结果
患者人群、植入物存活率和成功率
在前瞻性病例系列研究中,最初的42例患者有58枚植入物(Straumann AG,巴塞尔,瑞士),其中4例患者因离开或高龄和/或健康状况不佳而无法参加10年的检查。失访率达9.5%。共38例患者(52枚种植体)完成10年随访,其中男19例,女19例。患者年龄28 ~ 80岁,平均456 13岁。在吸烟习惯方面,32例患者(84%)不吸烟,5例患者为轻度吸烟者(每天最多10支烟)(13%),1例患者为重度吸烟者(3%)。36例患者(95%)在10年期间继续接受常规维持治疗,每年至少检查1次。1枚种植体在使用5年后因种植体周围感染而脱落,随后被新的种植体取代。1枚种植体有种植体周围感染史,另1枚种植体因骨水泥过量而出现种植体周围感染。10年检查时,两枚种植体均显示种植体周围健康,无种植体周围骨丢失的迹象,生存率和成功率为98.1%40,41(表1)。7个颏部采集位点在骨块采集后出现暂时性神经感觉障碍,在2 ~ 6个月之间完全消退。7例患者中,3例表现为下唇暂时性神经感觉障碍,3例表现为下切牙牙髓敏感性阴性,1例同时表现为下切牙牙髓敏感性和下切牙牙髓敏感性。
I种植体类型,种植体位置和种植体支持重建
在检查时,51枚种植体已经使用了12年。40枚种植体位于上颌前牙区,11枚种植体位于下颌后牙区。种植体颈部均为软组织水平设计,直径分别为1.8 mm(35枚)和2.8 mm(16枚)。最常用的种植体直径为4.1 mm(82%),最常用的种植体长度为10 mm(61%)。51枚种植体支撑的金属陶瓷修复体包括:SCs,(n538)3枚夹板SCs,(n5 3)1枚带悬臂的(n51的金属陶瓷修复体(SC)和种植体支撑的金属陶瓷修复体FDPs.(n5 9)。21枚修复体采用粘接固定,30枚修复体采用螺丝固定。48例患者无并发症发生,1例出现碎裂,2例出现中央螺丝松动10年期间,导致机械并发症的发生率为5%。
10年临床种植体周围软硬组织参数
通过精确的Wilcoxon-Mann-Whitney U检验分析,临床软组织参数显示,在mPLI方面,下颌骨和上颌骨之间没有差异,而mSBI, PD和DIM在上颌骨显著较高(图4)。
总体ANOVA显示,与下颌骨相比,上颌的DIB参数值明显较低(p 5 0.006)。上颌骨平均骨丢失20.17 mm,下颌骨平均骨丢失20.09 mm。有趣的是,从第一次到10年的检查之间没有发现显著的骨丢失的上颌骨和下颌骨(p 5 0.1773)。
频率分析显示92%的种植体显示边缘骨吸收小于20.5 mm,而8%显示边缘骨吸收介于20.5和20.8 mm之间。最大骨吸收达0.8 mm。手术时、6个月和10年时的总骨增加和表面吸收率
共51个种植位点进行了复查。术前平均残余牙槽嵴顶宽度为3.166 ~ 0.76 mm。术后牙槽嵴顶宽度平均为8.1、1.02 mm。从牙槽嵴增大到植体植入的平均愈合时间为6.296 ~ 1.84个月。再入路时,骨嵴宽度为7.756 ~ 0.99 mm。在第10年检查时,嵴宽度达到8.066 1.49 mm。从手术到6个月,应用的块移植物的整体表面吸收量为6.9%(平均50.34 mm),从手术到10年的整体表面吸收量为7.7%(平均50.38 mm)。在术后6个月和10年随访期间,增加部位的表面吸收量没有显著性差异(平均5 0.046 1.68 mm, p 5 0.2426)(,图4)。
影响移植物吸收的因素
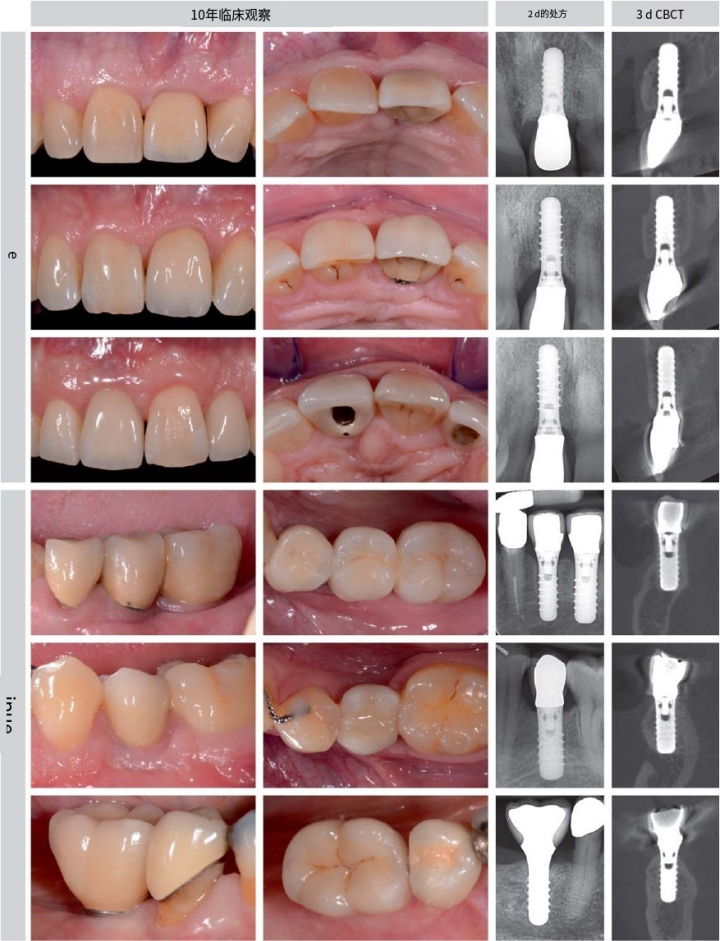
图4 三个具有代表性的病例系列的上颌骨和下颌骨,在10年的检查中显示只有轻微的移植物吸收。
在全球方差分析测试中,骨移植吸收随时间变化显著(p 5 0.0069)。有趣的是,在整体方差分析中,受体部位对移植物吸收没有显著影响(p 5 0.6281)。上颌表面吸收率在6个月时为20.39 mm 6 0.54 mm,在10个月时略有增加0.17 6 1.6 mm由于在8个位点重新植骨。下
颌骨显示吸收率为20.186。
术后6个月为0.25 mm,术后10年为20.816 ~ 1.79 mm。在总体测试中,供体移植物的来源及其与时间的交互作用是显著的(p 5 0.0187为供体移植物,p 5 0.0005为供体移植物。post-hoc检验显示在10年时,颏移植物比磨牙后移植物有更好的移植物维持(p 5 0.0076)。在6个月时,颏移植物的表面吸收率为20.37 mm 6 0.53 mm,略微增加了0.226。
8个部位再次植骨,术后6个月表面吸收率为1.53 mm。磨牙后移植物显示6个月时吸收率为20.226 0.26 mm, 10年时为21.25 6 1.98 mm。没有影响,但显示了与时间的显著交互作用(p 5 0.0030)。在10年后的事后检验中,女性比男性显示出显著更多的骨丢失(p 5 0.0438)。在全球ANOVA中,年龄对骨质流失没有显著影响(p 5 0.5931)。
讨论
本研究揭示了良好的10年种植体成功率为98.1%,种植体周围的骨吸收最小。此外,在愈合期间,由DBBM和胶原膜保护的自体骨块显示,在牙槽嵴增量后10年的最小表面吸收率为7.7%。颏部移植物与磨牙后移植物相比,显示出对增量部位显著更好的维持。受者部位和年龄对移植物吸收没有显著影响,而女性在10年检查中显示更多的骨丢失。
植骨吸收是植骨愈合和融入骨受体部位的固有结果。这些部位似乎显示了一种与骨折愈合密切相似的特定骨重建模式。在移植物骨整合后,由于坏死或废弃皮质骨的破骨细胞吸收,自体移植物继续重塑,随后成骨细胞形成新的编织骨,之后重塑为更强的板层骨。通过这种方式,自体移植物通过正常的骨稳态得以维持。在最初的6个月,可以观察到骨皮质的早期吸收,而从6个月到12个月,骨密度不仅在剩余的骨皮质增加,而且在松质区也增加。以前的报告从组织学角度研究了有或没有屏障膜和/或DBBM保护的自体骨块的骨模型,这些临床和实验研究表明,在移植物的核心内,无论手术入路如何,都观察到移植物-宿主的完全整合,屏障膜和/或DBBM对骨块的保护显著影响了骨表面的吸收。两项临床研究表明,结合不可吸收膜或DBBM颗粒支持的可吸收膜可最大限度地减少愈合过程中移植物的吸收。本研究中观察到的0.38 mm(7.7%)的最小吸收率证实了这些结果,并且即使经过10年的观察期,似乎仍然有效。
移植物吸收背后的潜在机制尚不完全清楚,但移植物的微结构等因素可能会影响愈合期间的血管化程度。其他一些因素(如胚胎起源、方向和移植物尺寸)被认为是自体移植物体积维持不良的影响因素。作者观察到,与皮质较薄的移植物(髂骨)相比,皮质较厚、密度较高的植骨块(如来自颅骨或下颌骨的植骨块)通常显示出更高的稳定性。相反,骨块的松质部分在刺激成骨细胞分化为成骨细胞以形成新骨方面具有重要功能。此外,与皮质骨移植相比,松质块移植部分的血运重建更快。因此,在皮质松质骨移植中,结合这两种特性促进了早期血管化,同时最大限度地维持了移植物。在这项研究中,来自颏部的骨块在10年的观察期中显著较好地维持了其体积,而来自下颌支的骨块在10年检查中显示出显著较多的吸收。可以假设,颏部和下颌升支移植物之间的这种差异可能与移植物的微结构差异有关,因为来自下颌升支的移植物与颏移植物相比,似乎具有较厚的皮质和较少的松质部分。
受区皮质骨穿孔或去骨膜被证明有利于骨移植物与宿主骨的最佳融合,因为致密的骨皮质和皮质骨内骨内膜细胞的缺乏减少了血运重建。大量研究报道了两者之间密切的动态相互作用血管生成和骨形成。因此,与未穿孔的受体区域相比,穿孔显示有利于骨移植物融入宿主骨,甚至减少了移植物的吸收。这一观察结果可以通过更快的血管化来解释,如VEGF标记所示,当受体床的皮质层被切断时,使得骨重建过程加速和增加了骨沉积。这些皮质骨穿孔为血管和祖细胞接近移植物间室提供了一条途径,并已在GBR手术中常规应用。因此,受体部位的准备也可能有助于本研究的有利结果。
总体而言,关于分期植骨手术的生存率和成功率的研究报告是异质性的,因此比较是不可行的。4在髂骨移植重建的患者中植入种植体的存活率为86.5%,颅骨移植的存活率为94.9%,口内移植的存活率为97.1%。使用自体骨块进行牙槽嵴增量的长期研究非常罕见。Nystr€om等报道,使用髂骨块对萎缩的上颌骨进行onlay移植,在加工表面的种植体中有90%的存活率,10年后平均边缘骨吸收2.4 mm。在一项平均随访29个月的回顾性横断面研究中,Cordaro等报道的生存率和成功率分别为98.6%和95.8%,这与本10年研究中98.1%的种植体成功率一致。最近的一项系统综述表明,在再生部位放置种植体的同时和分阶段治疗策略可获得较高的生存率和成功率(>95%)
种植体周围骨吸收是影响种植成功的关键因素。在本研究中,种植体周围骨水平在10年的观察期内保持稳定,在分期牙槽嵴增量后,上颌骨和下颌骨的平均骨吸收分别为20.17 mm和20.09 mm。最近的一项研究证实了这些发现,10年后每个种植体的骨吸收在0.48 - 0.30 mm之间。有趣的是,在10年的观察期后,同时进行的牙槽嵴增量手术产生了相似的种植体周围骨吸收范围在0.52和0.7 mm之间,12.5年后骨水平的平均变化为0.081 mm/年。这些发现证实,使用分期牙槽嵴增量的再生骨显示10年后种植体周围骨水平的轻微变化,这与同时放置的种植体增量位点相当。
目前的研究有局限性,结果需要谨慎解读。首先,在同时使用GBR植入种植体后,有8个种植体部位需要进行少量的再移植,这在计算中不能排除。因此,由于种植手术时的代偿性增加,增量部位的有效表面吸收率可能略高。其次,由于伦理原因,10年的牙槽嵴宽度分析是通过锥形束ct进行的,而不是通过翻瓣打开受植区进行的。因此,对于牙槽嵴宽度的测量,这两种测量方法不能完全标准化。
自体骨块移植与骨获取部位的额外发病率相关,特别是在颏部取骨。因此未来的研究和发展是必要的,以取代自体骨块移植的需求,从而减少患者的发病率。此外,生物医学软件的发展可以应用于种植体相关的研究,以便随着时间的推移,以标准化的方式分析增量的位点。
文献结论
综上所述,本研究在10年的随访期内显示了健康的种植体周围软组织参数和较高的种植成功率,该手术采用了由DBBM和胶原膜保护的自体骨块。增量部位的表面吸收率较低(7.7%),有利于增量部位的维持。影响术后10年移植骨块维持的主要因素为移植骨块的来源和性别。
CASS
前牙区引导骨再生种植美学修复
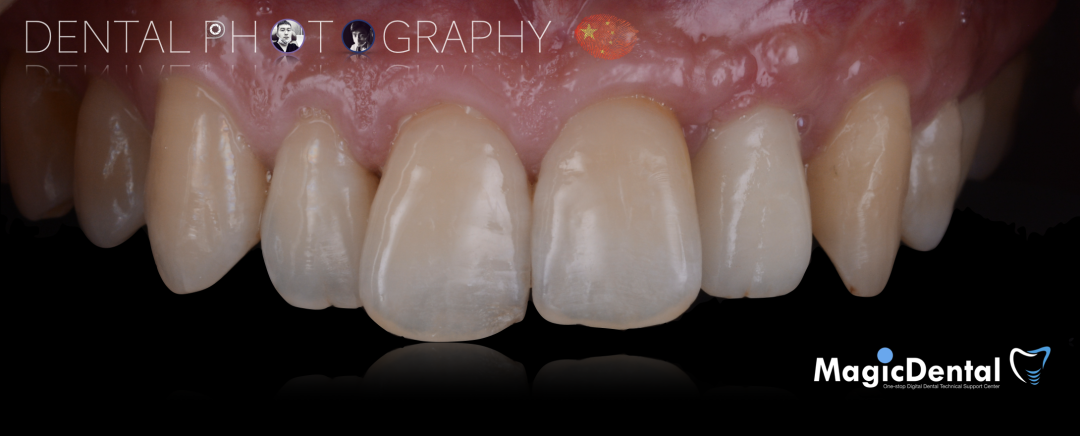
患者术前口内照片
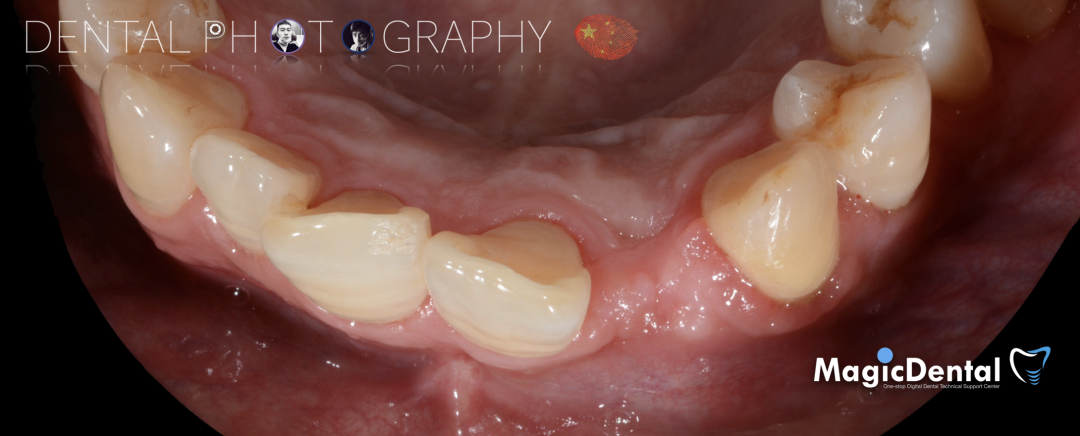
40岁男性患者。
主诉:左上前牙缺失求修复。
现病史:患者因外伤导致前牙松动半年之久,两个月前于外院拔除左上前牙,现自觉不美观来我院就诊。
既往史:既往体健,无其他系统病史,否认重大疾病史,有口腔拔牙史。口腔检查:口腔卫生良好,牙周状况良好,22缺失,缺失间隙约7mm,CT显示缺失牙位置唇颚侧骨壁薄,无对颌伸长,邻牙无移位,上下前牙呈深覆 ,38、48近中阻生。
辅助检查:术前化验,血糖5.2mmol/L,血压120/90mmHg,血常规全血分析无异常, HIV1/2:(-),HBsAg(乙型肝炎病毒):(-),HCV(丙型肝炎病毒):(-),TP(梅毒螺旋体):(-)。
诊断 21缺失。

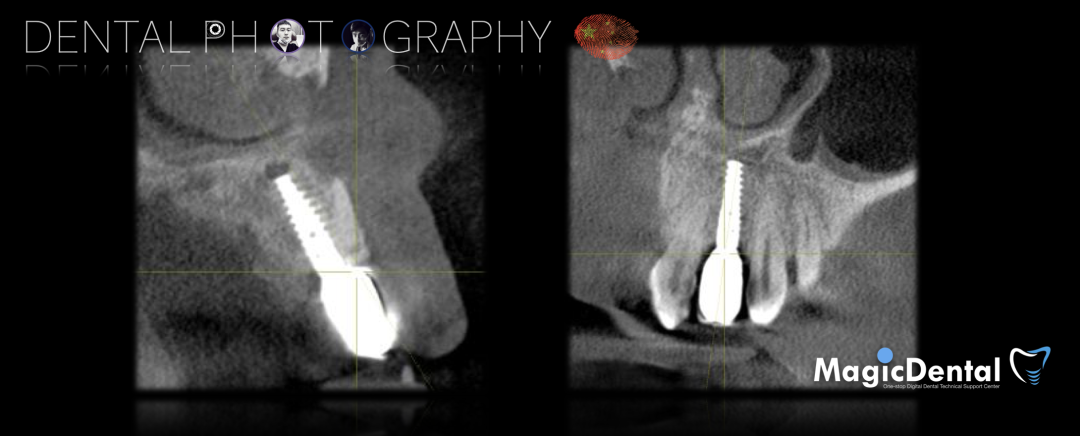
术前CBCT
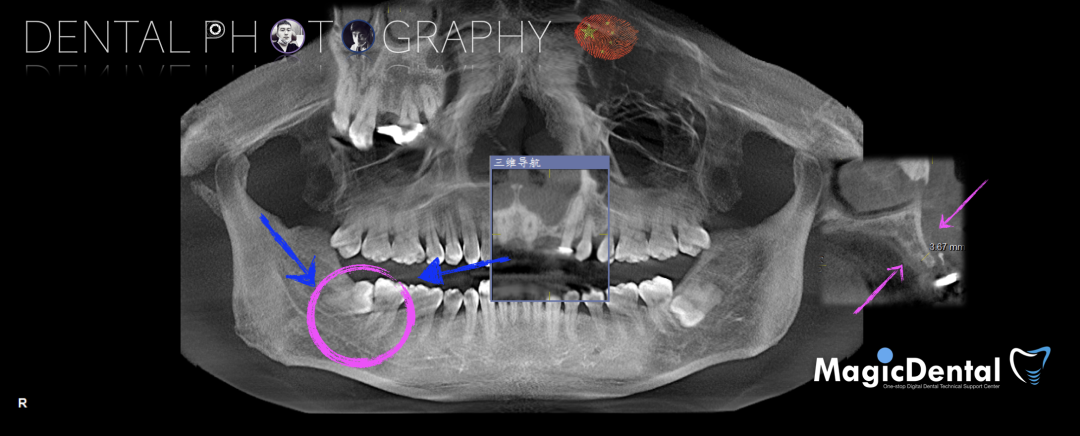
22缺失,且牙槽骨唇颚侧宽度较窄,38,48近中阻生。
治疗计划:水平骨增量,拔除四区近中阻生智齿,下颌升支外斜线处取块状骨,移植骨块至受区(22唇侧),种植修复22缺失牙。

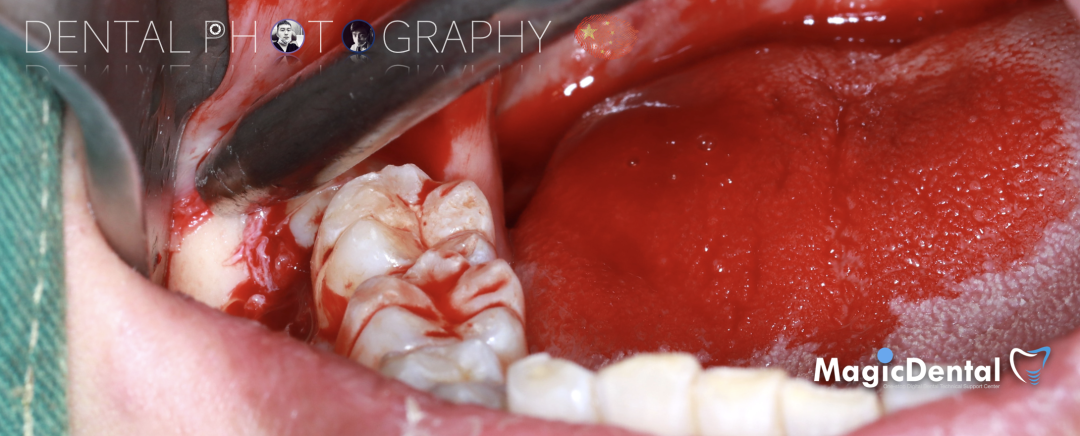
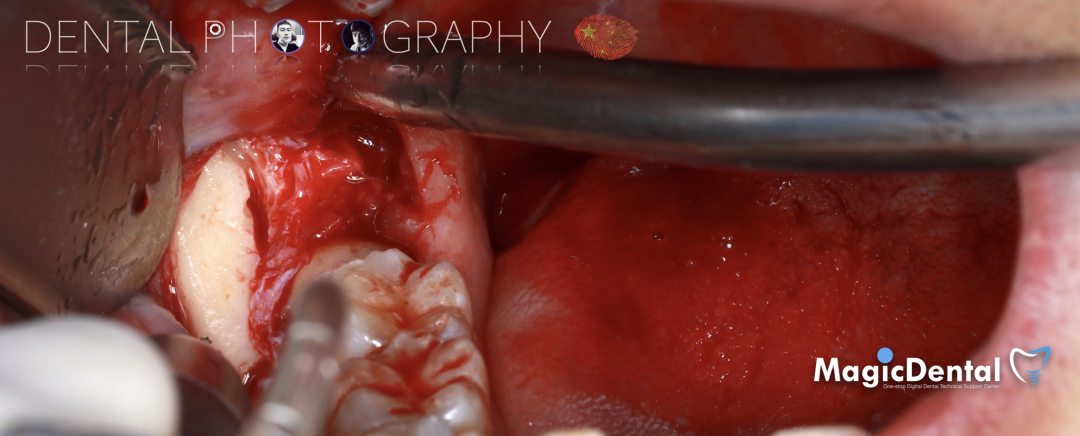

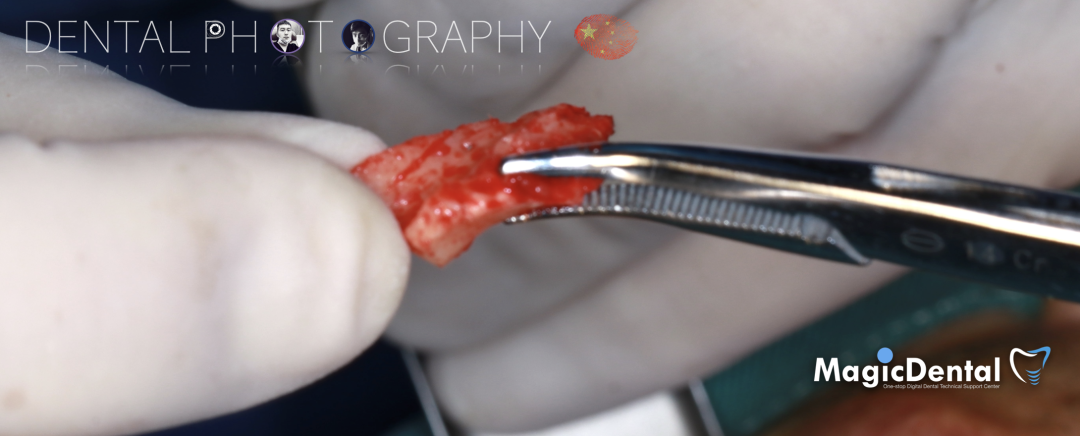
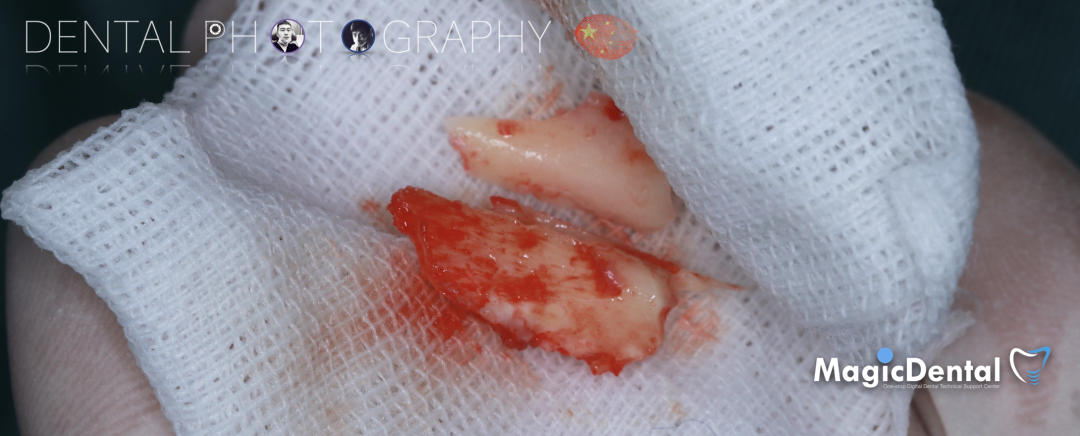
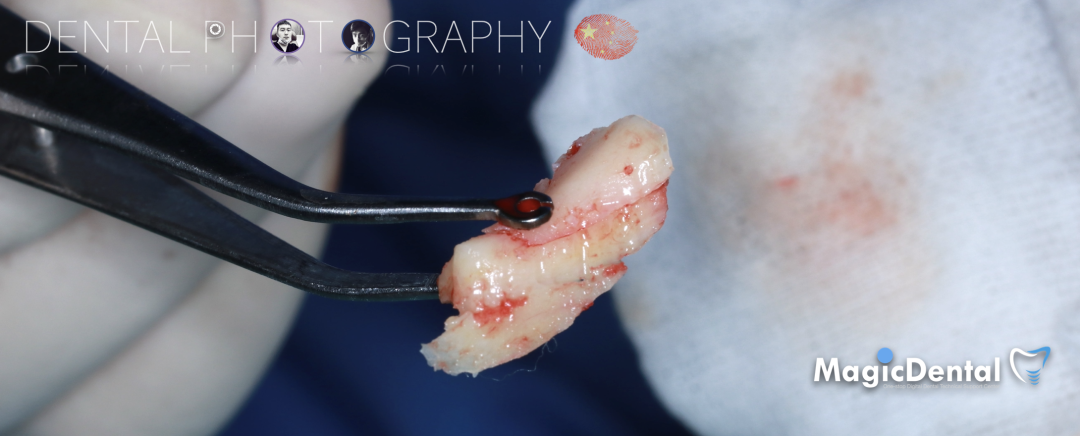
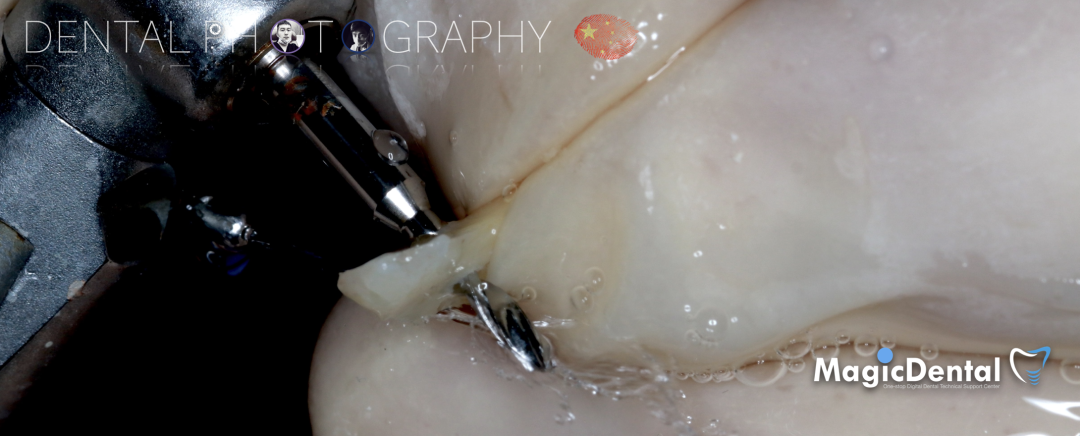
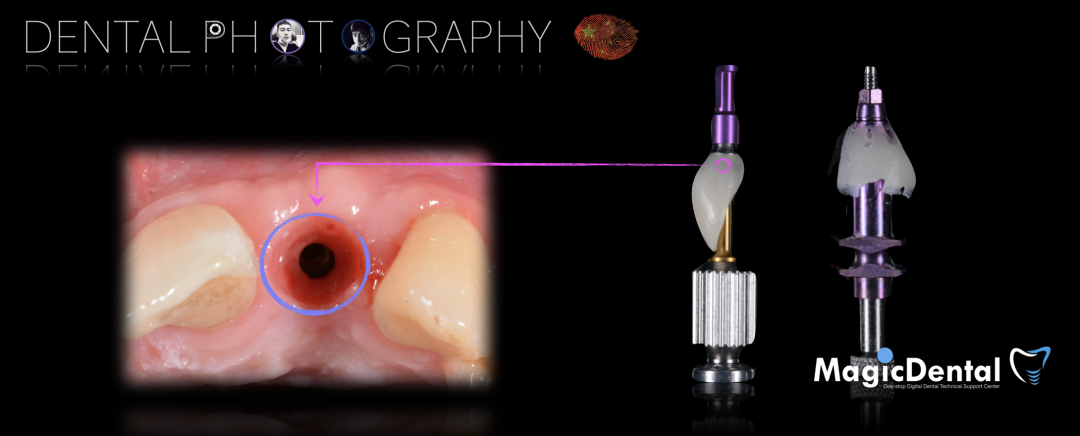
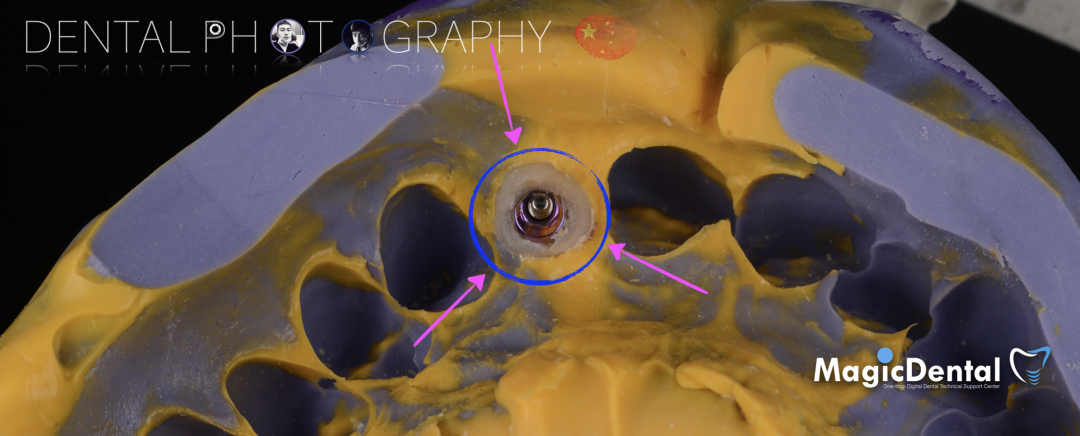
骨块细节
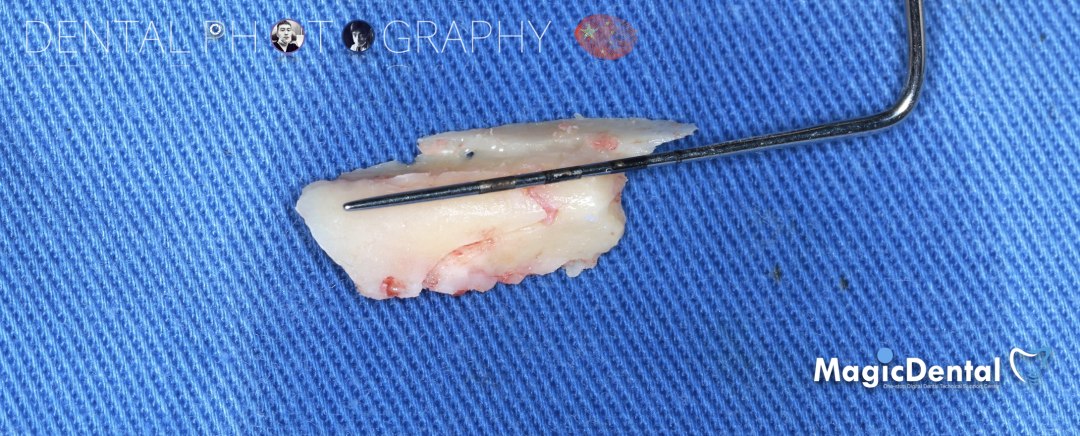

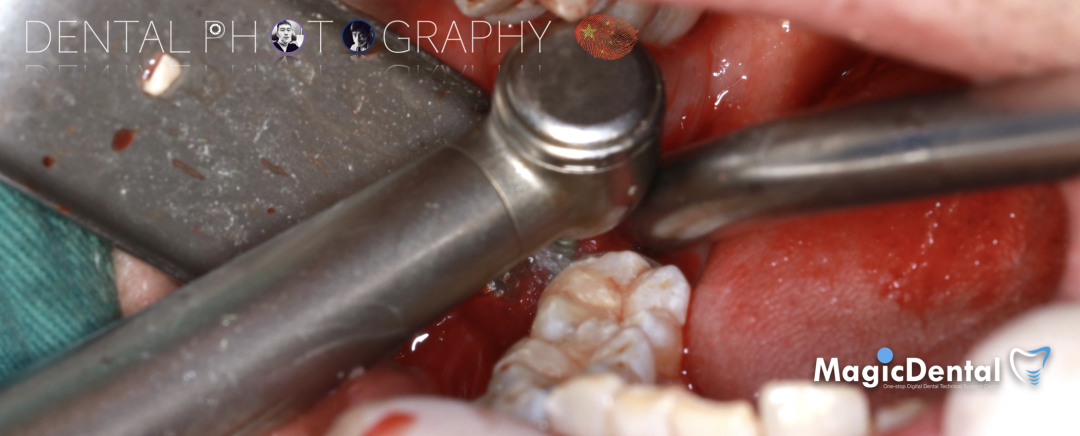
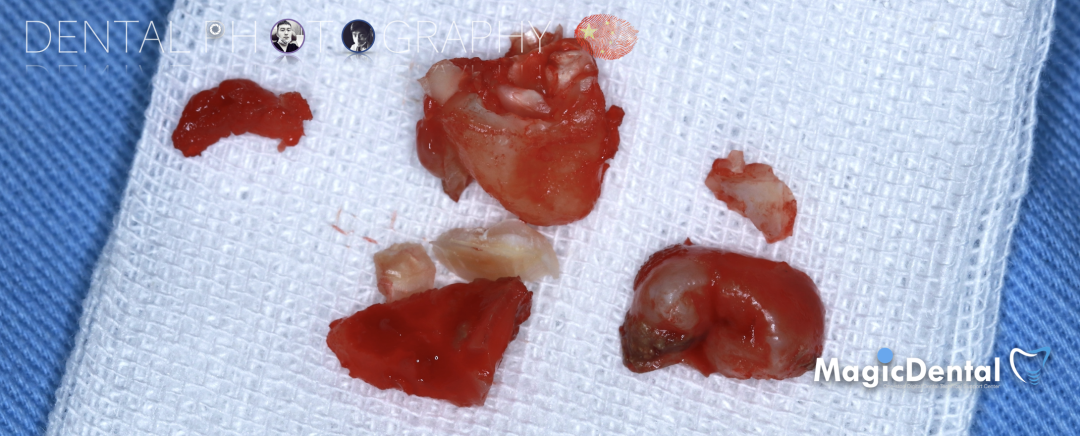


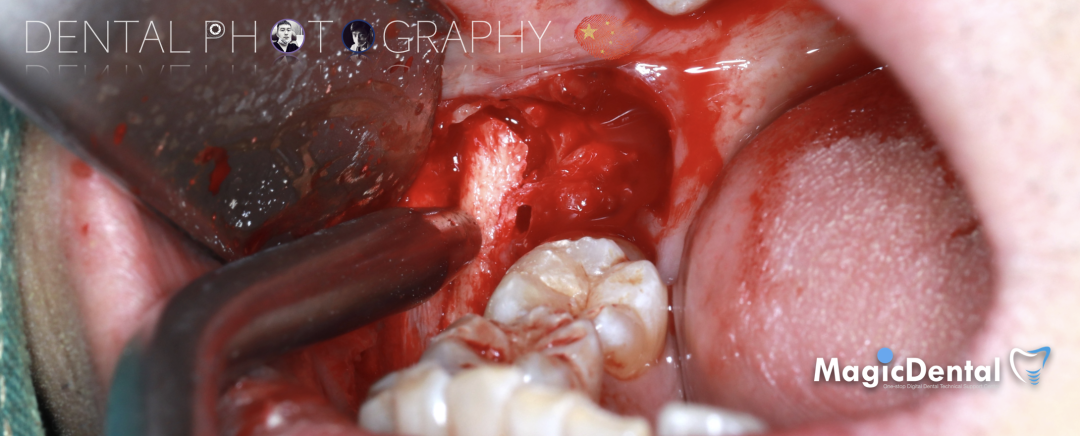
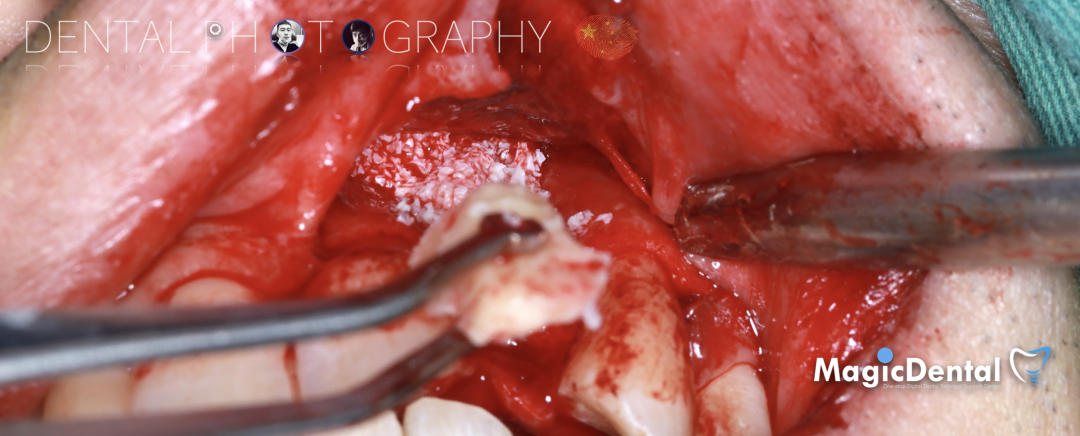
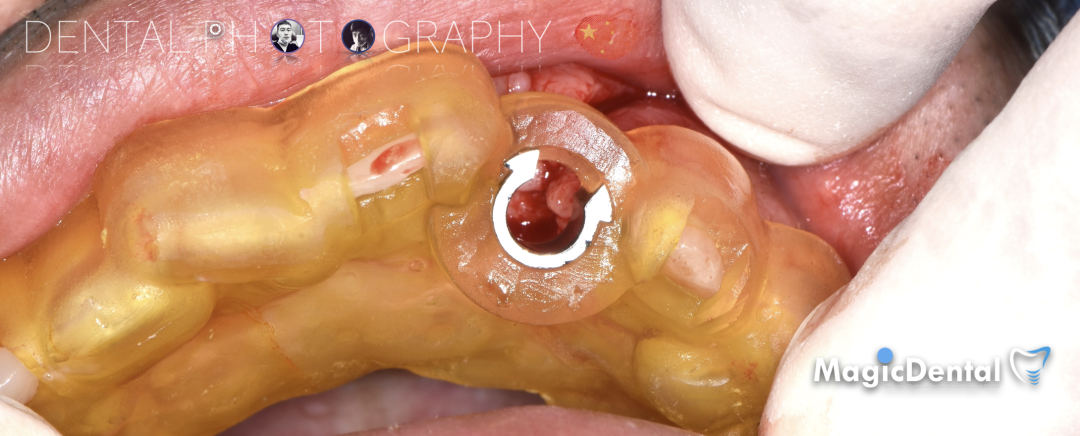
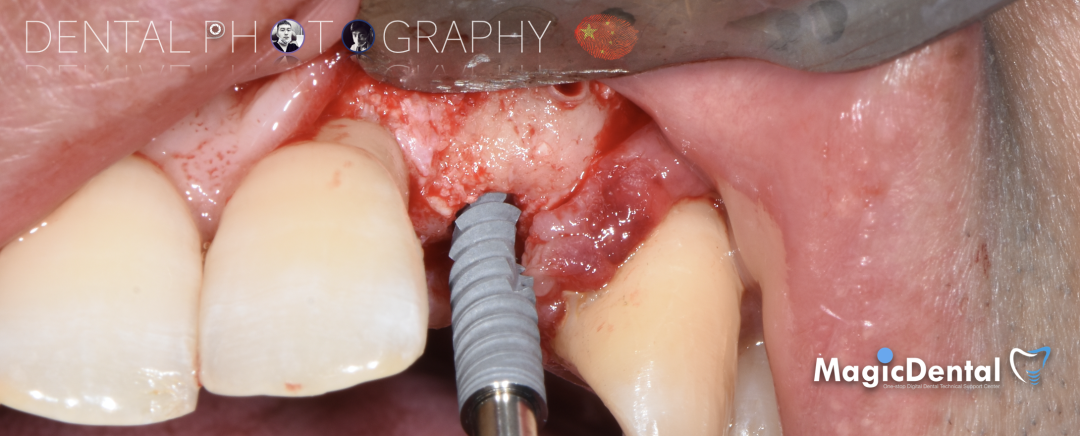
切开翻瓣,彻底暴露术区,试戴骨块。
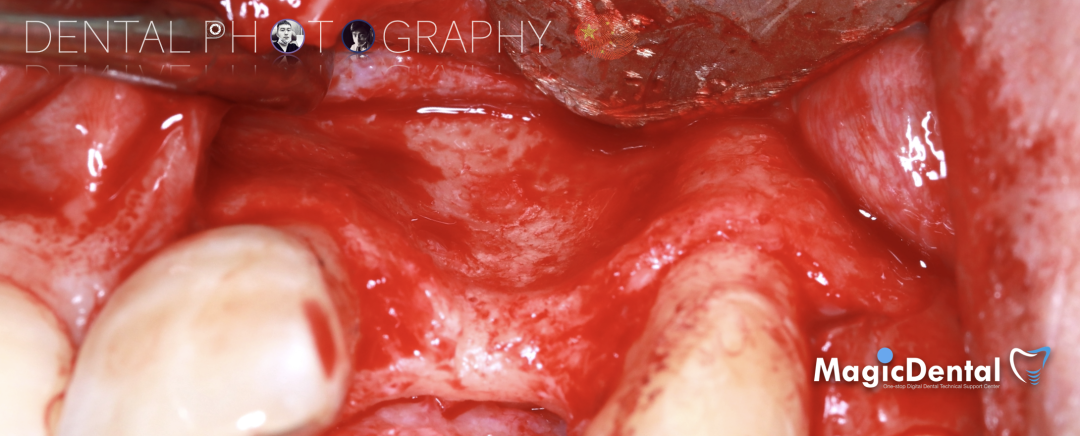
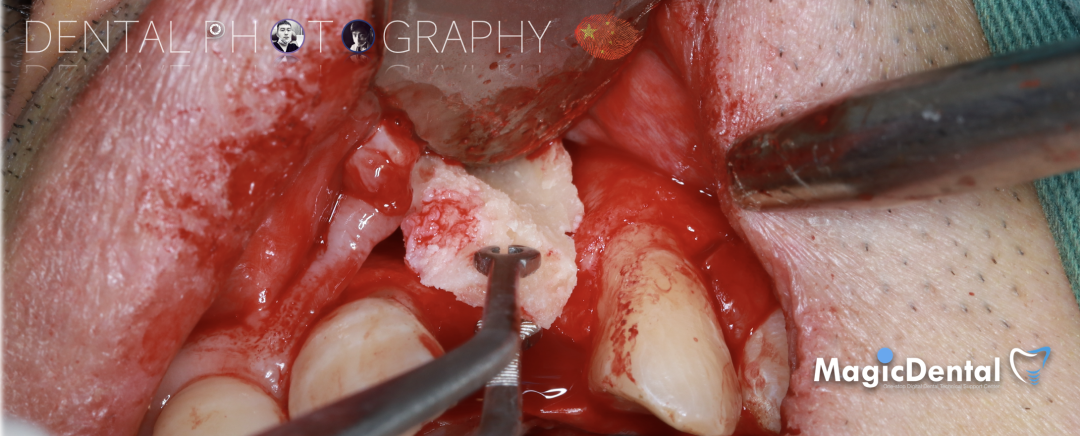

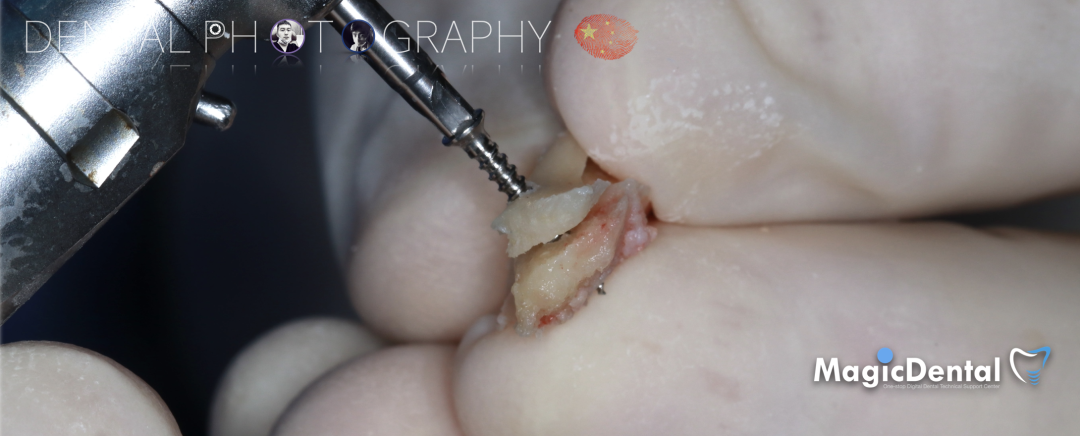
调整骨块外形,适配受植区域,打开骨髓腔。
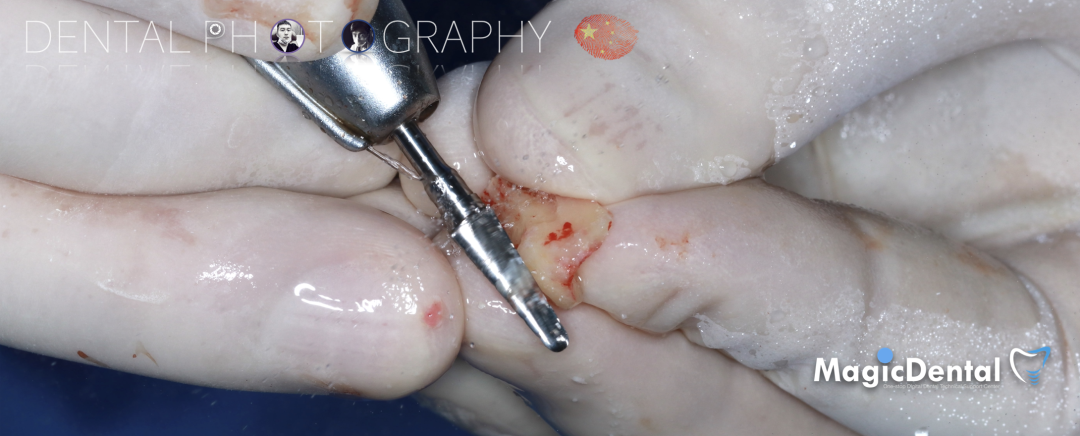
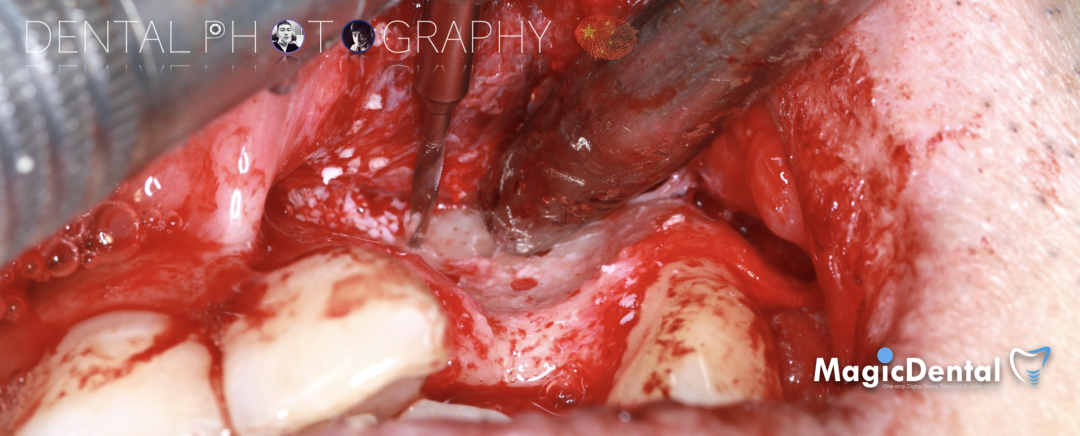
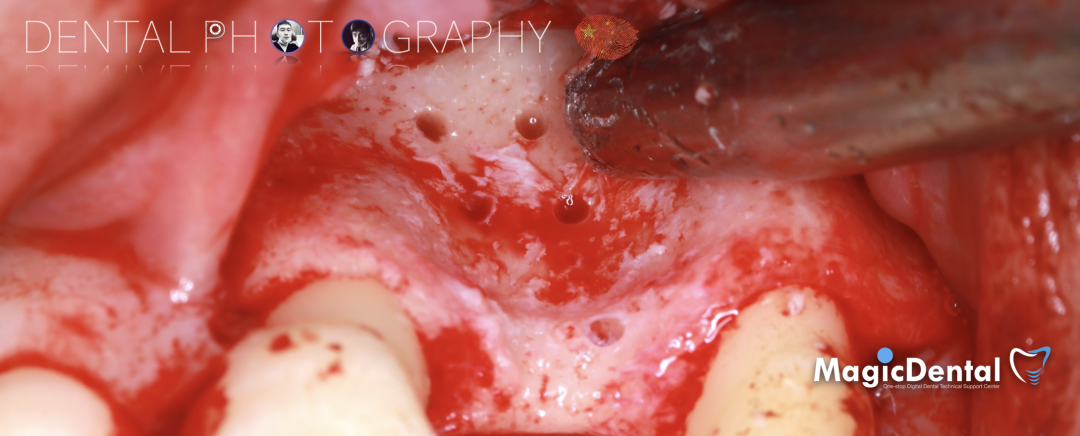

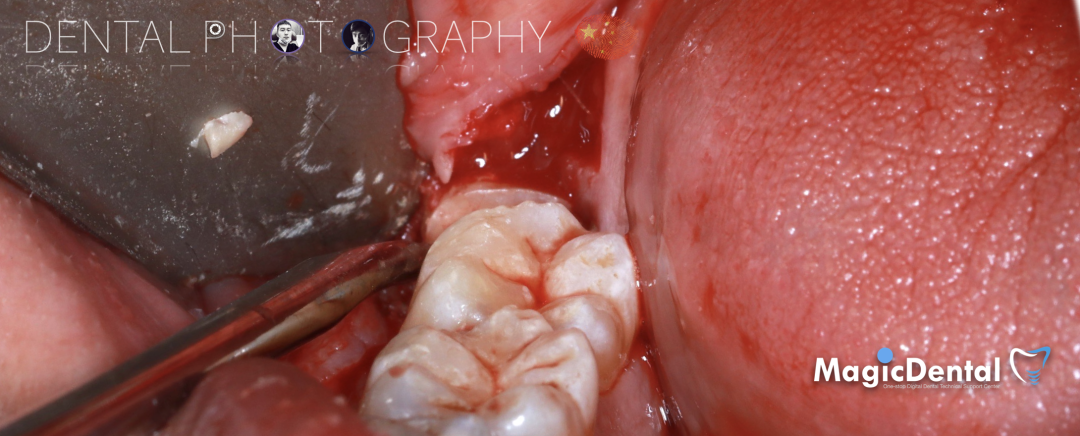
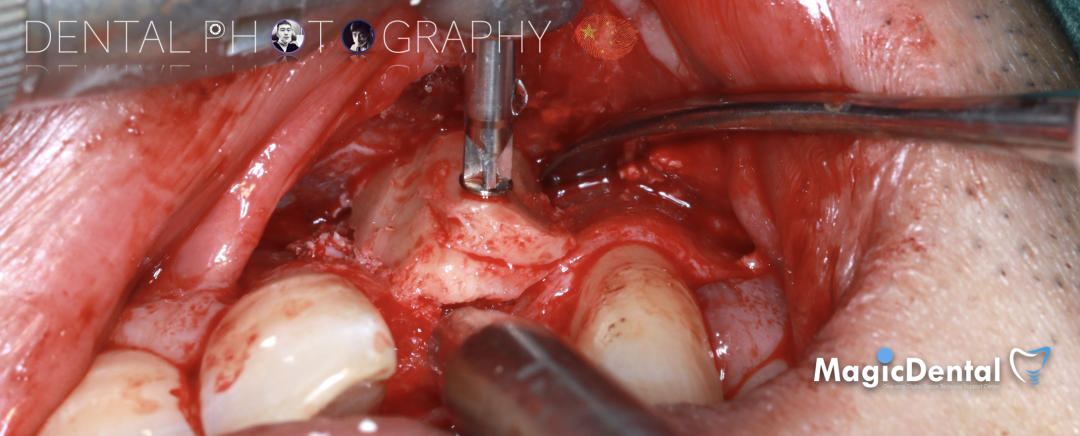
预备固位钉洞,固定骨块

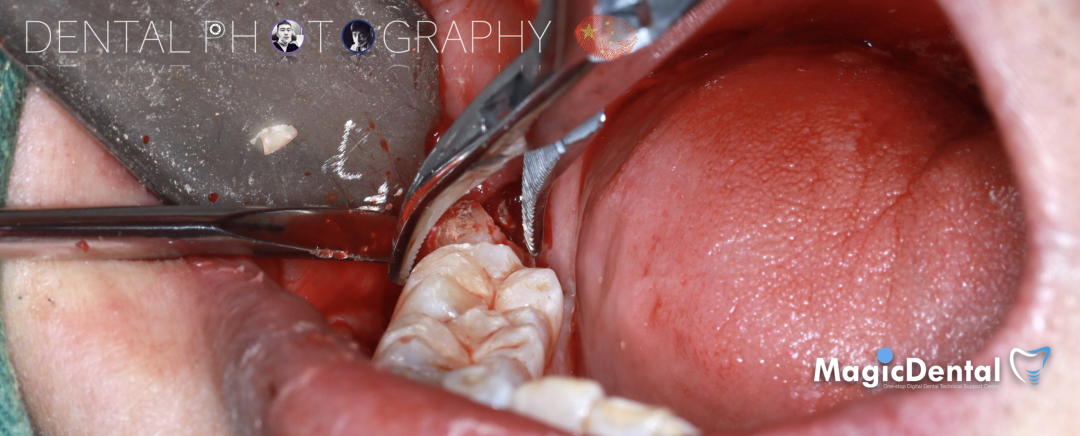
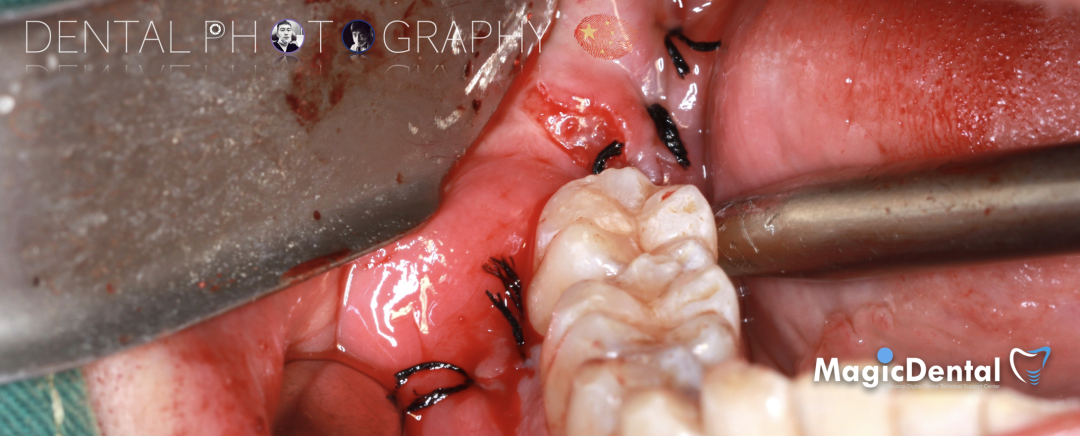
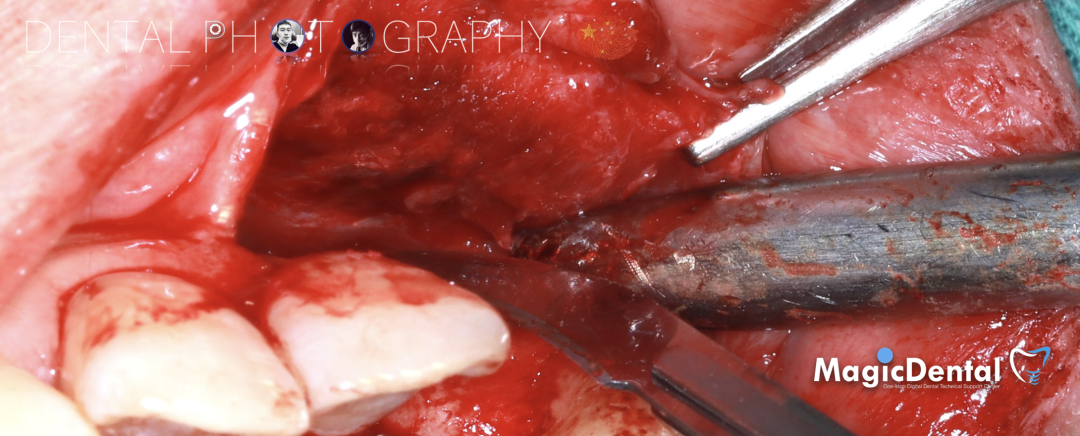
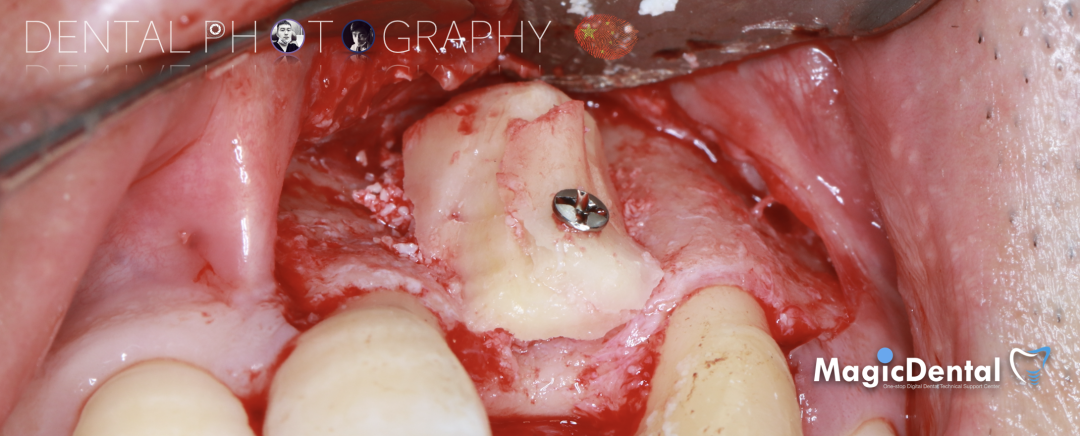
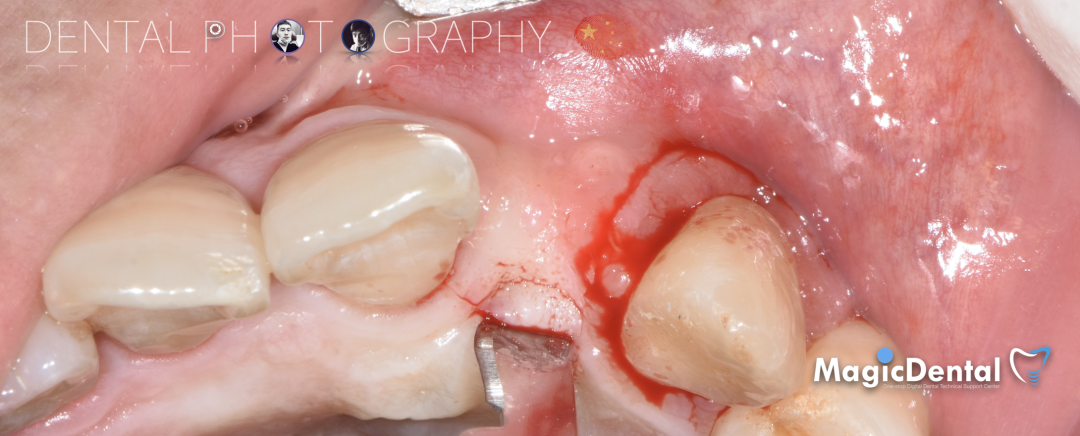
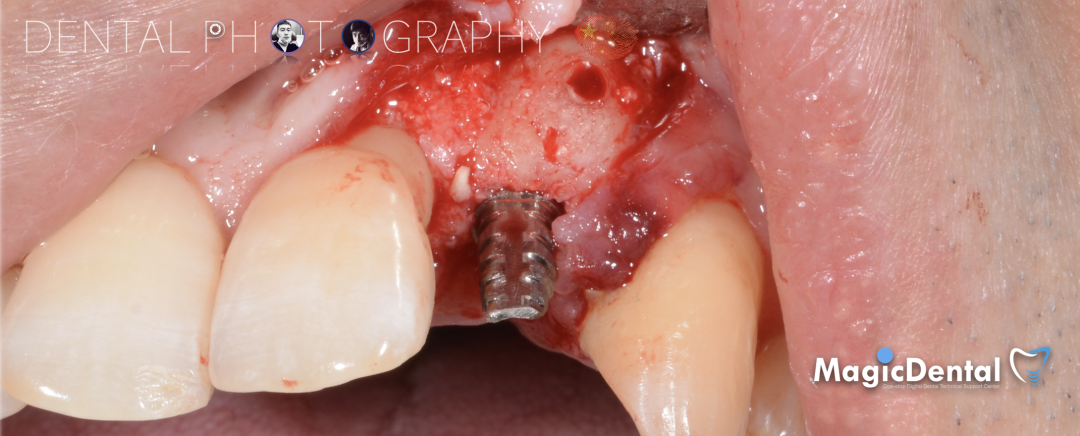
骨膜减张,放置骨粉,放置骨块,钛钉固定骨块。
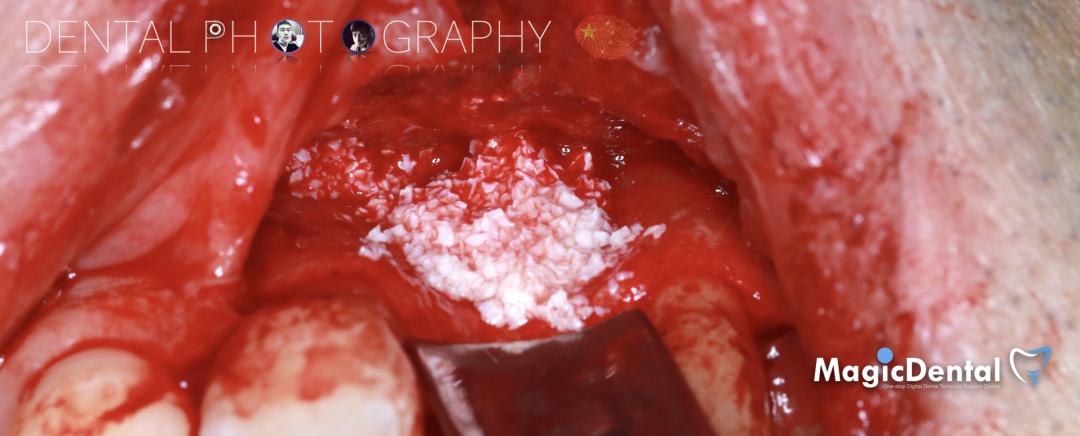
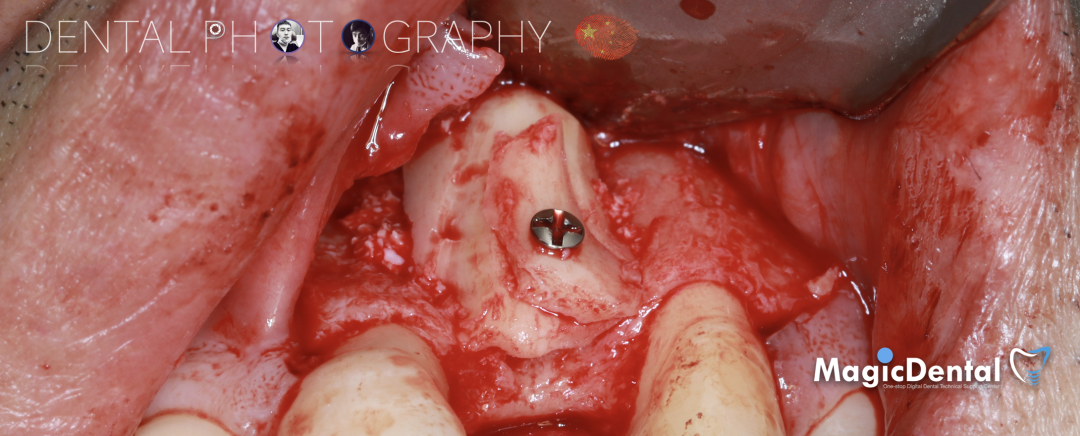

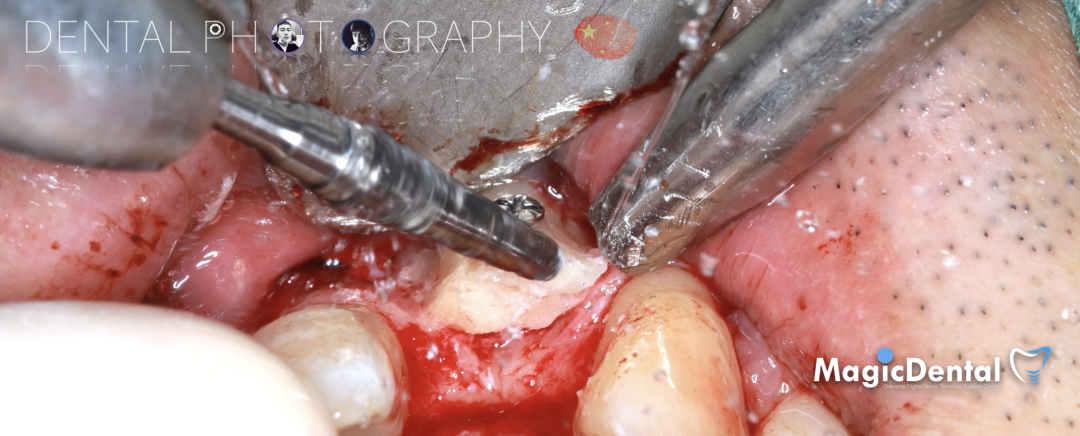
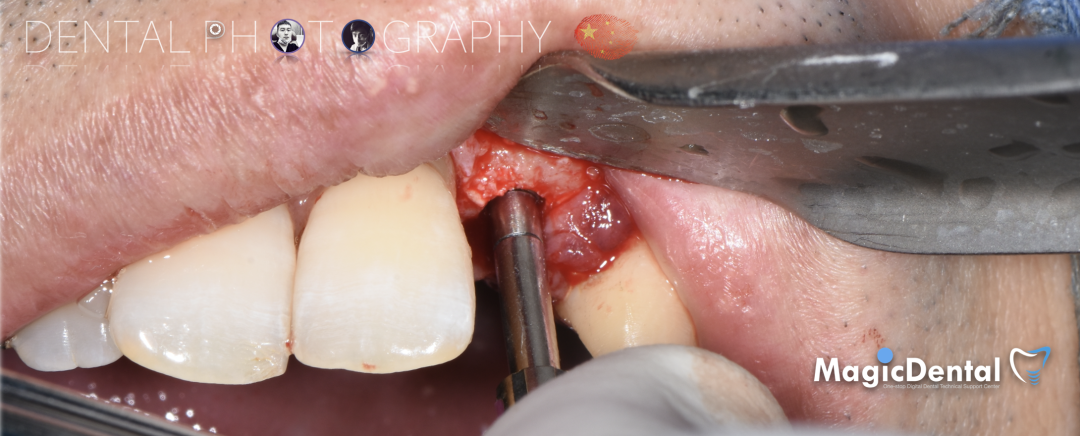
固定骨片,修整骨块边缘,继续放置骨粉覆盖骨块及受植区,放置骨膜,严密缝合创口。
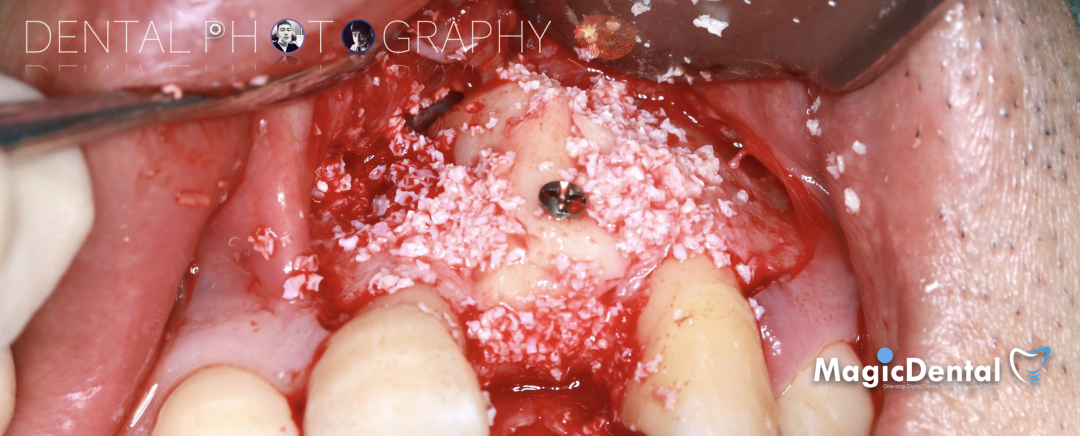
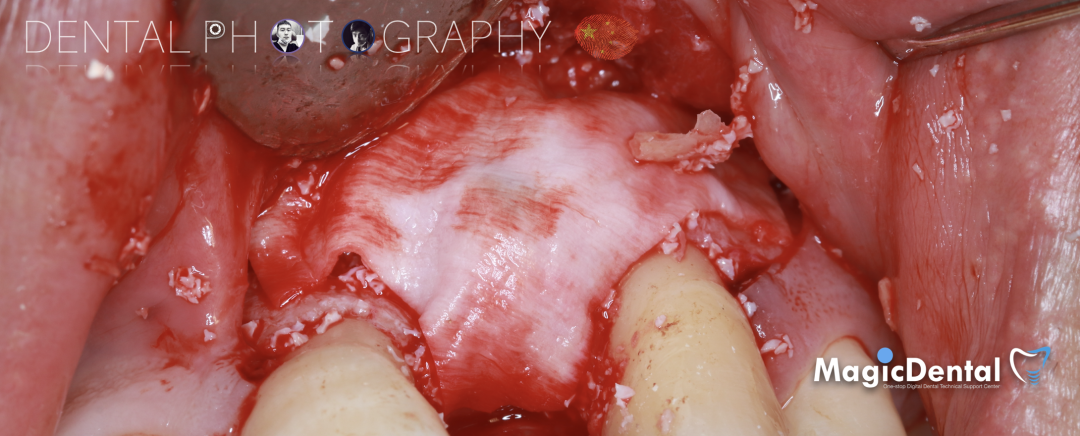
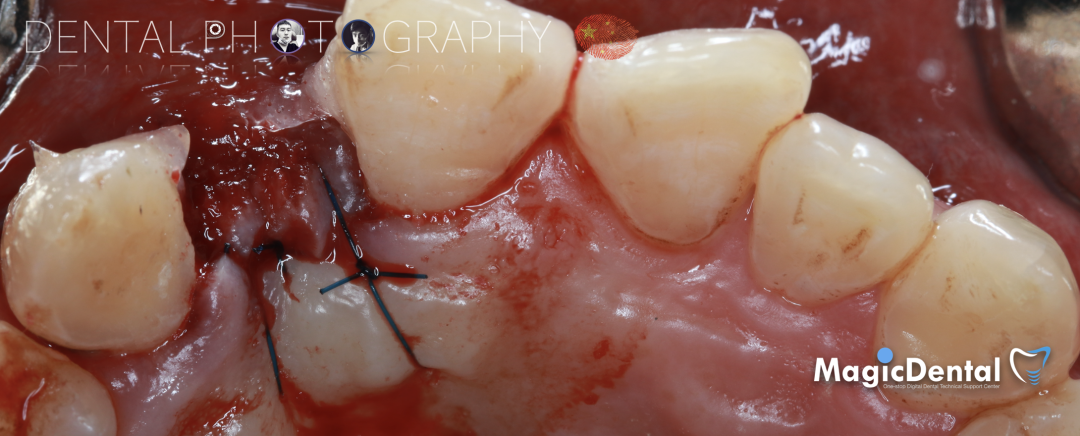

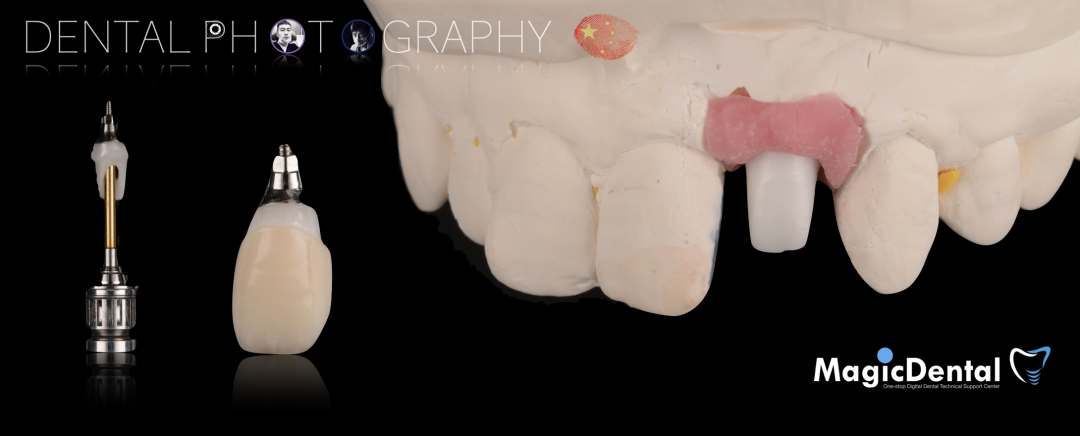
术后五个月复查及CBCT检查
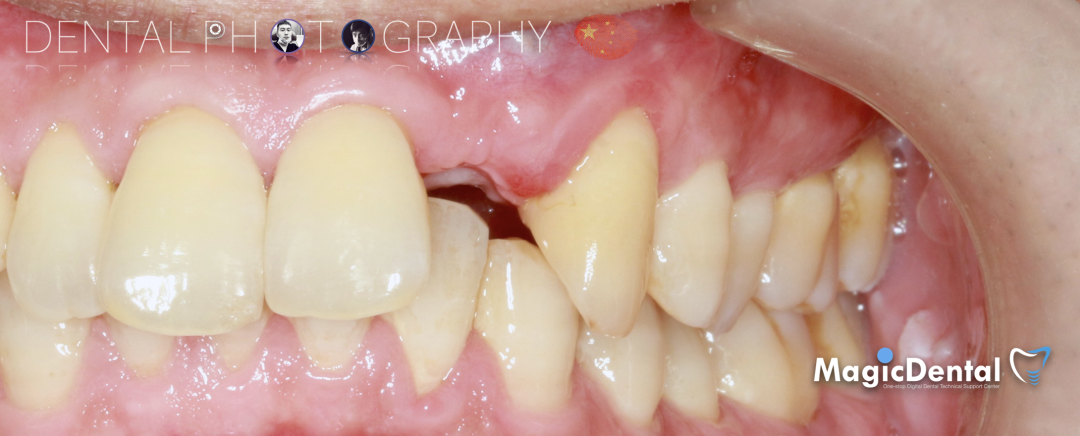
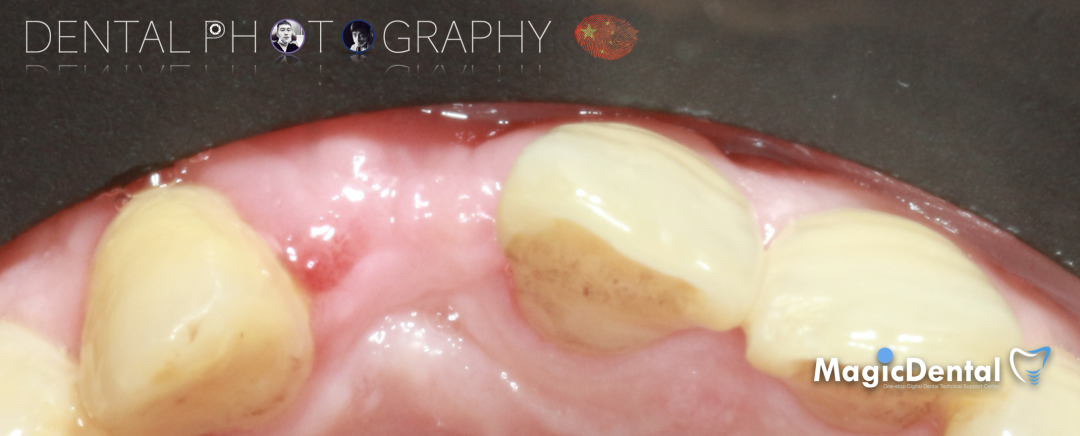
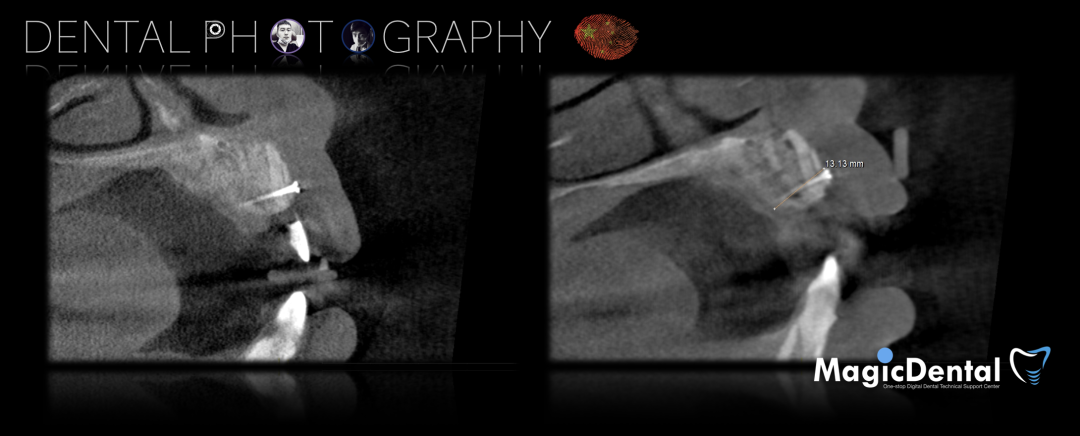

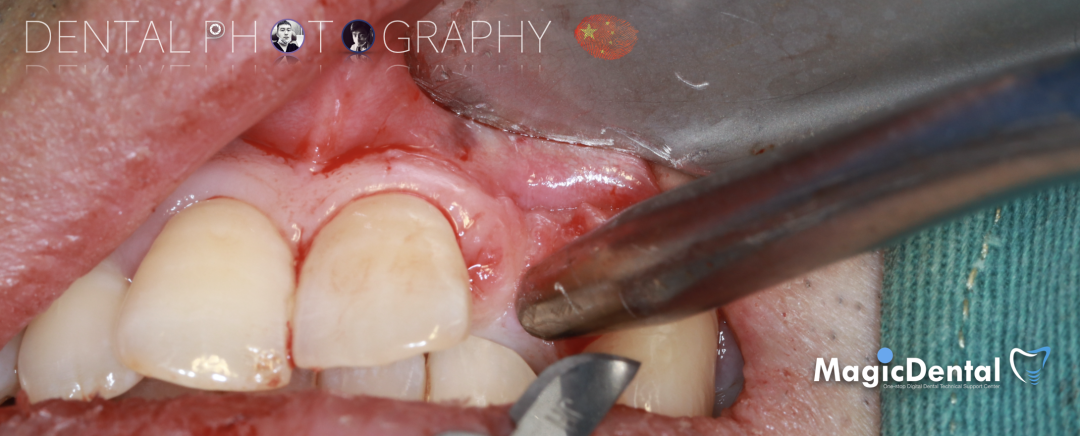
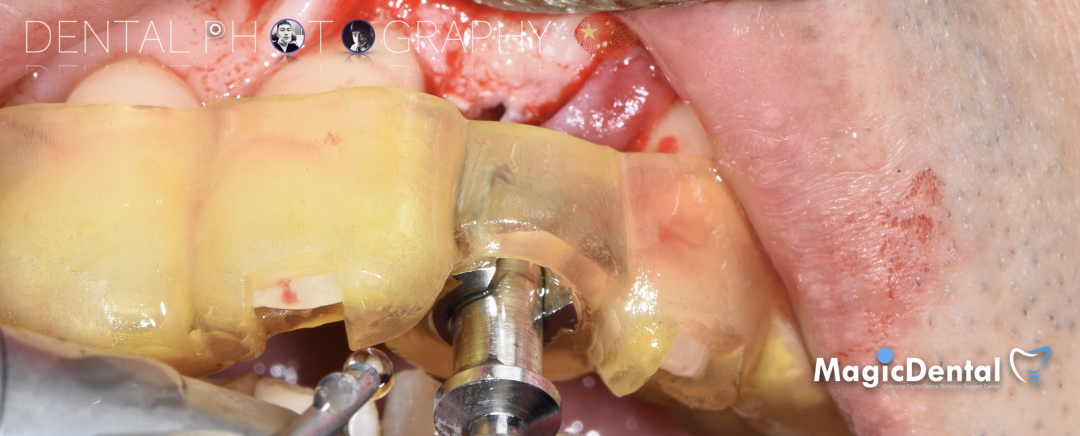
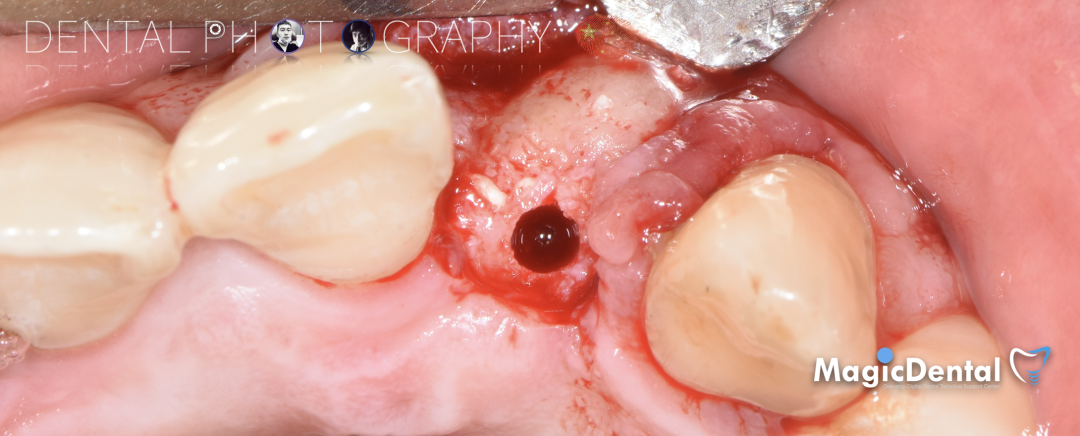
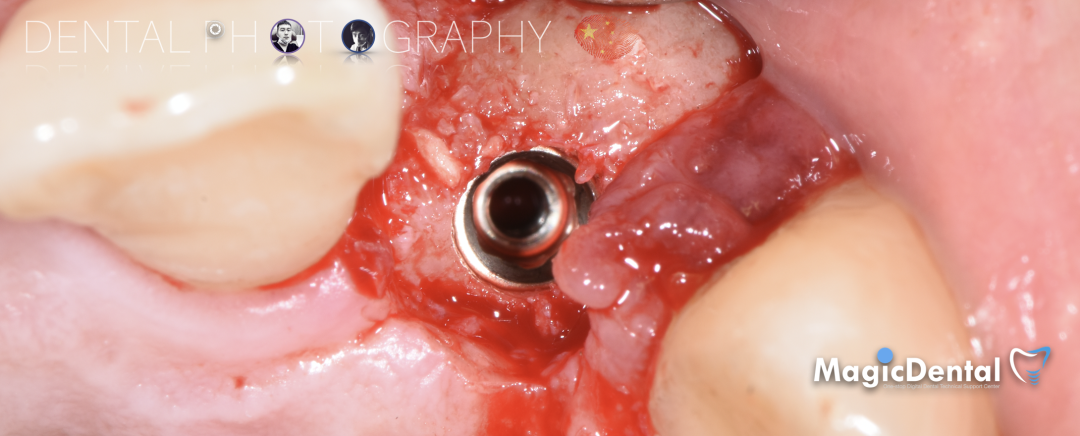
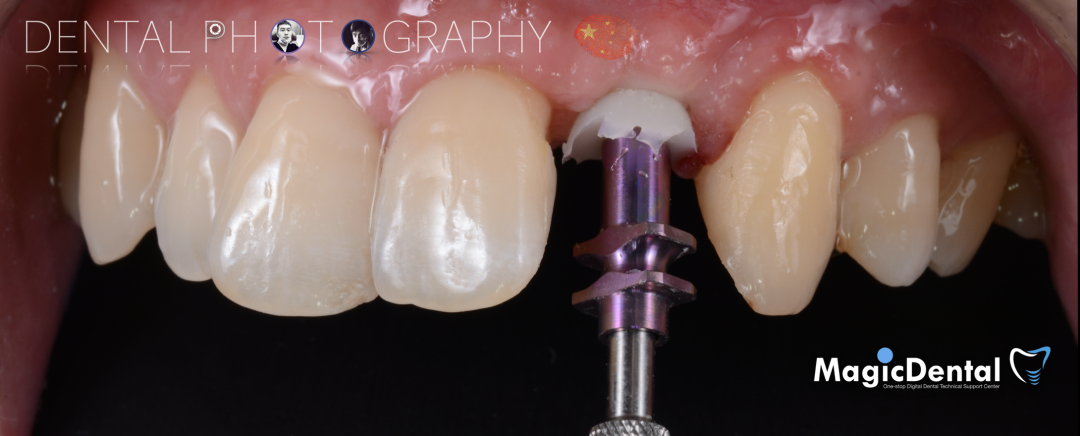
制作种植导板,局麻下切开,翻瓣彻底暴露术区,取出骨钉。
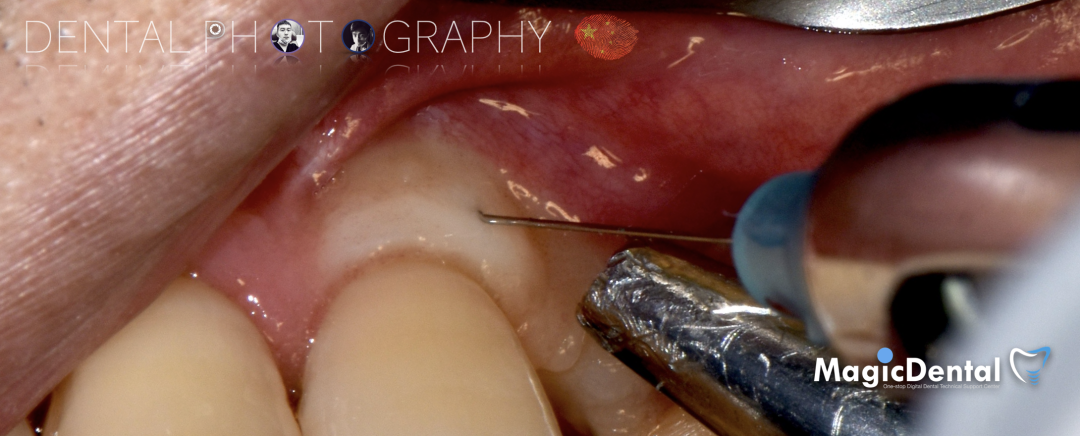
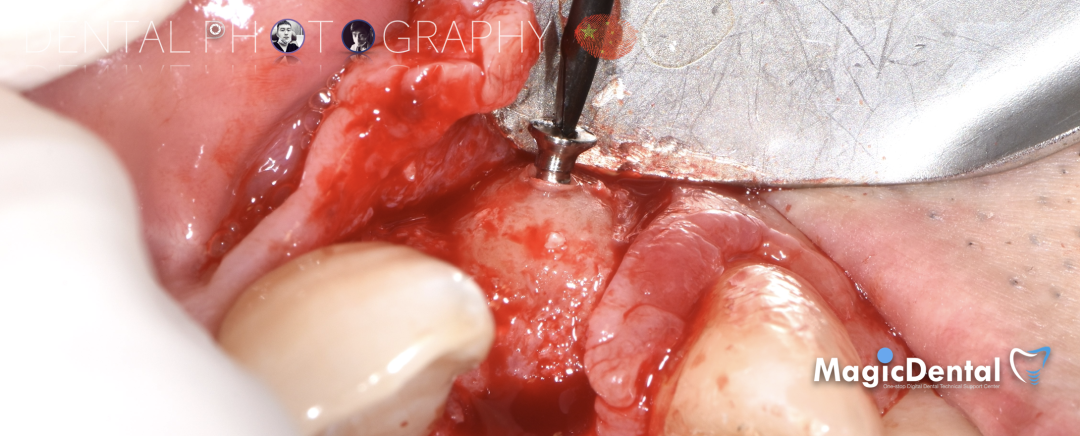

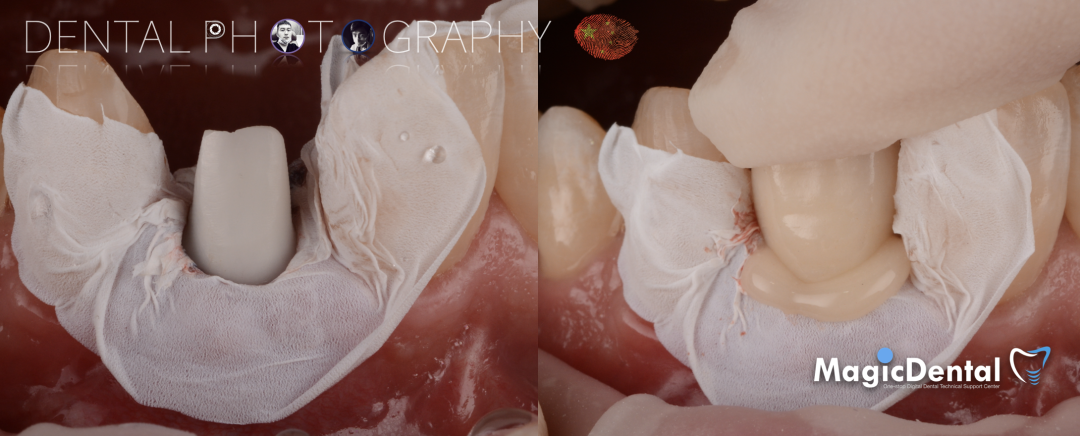
导板就位,种植窝洞预备,植入Nobel Active 3.5*15mm种植体一枚,植入扭矩35N,安装临时基台。

口外制作树脂临时冠,抛光。安放树脂修复的临时冠,调整正中、前伸、侧方均无咬合干扰。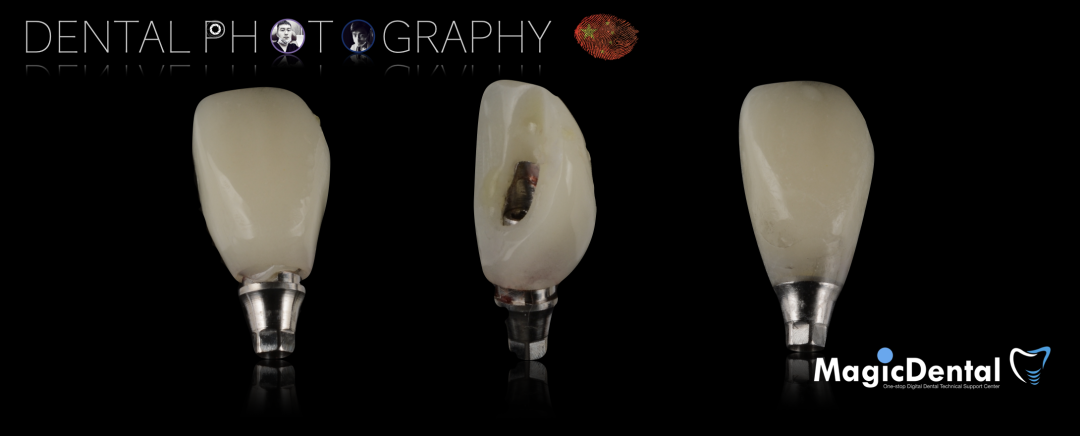

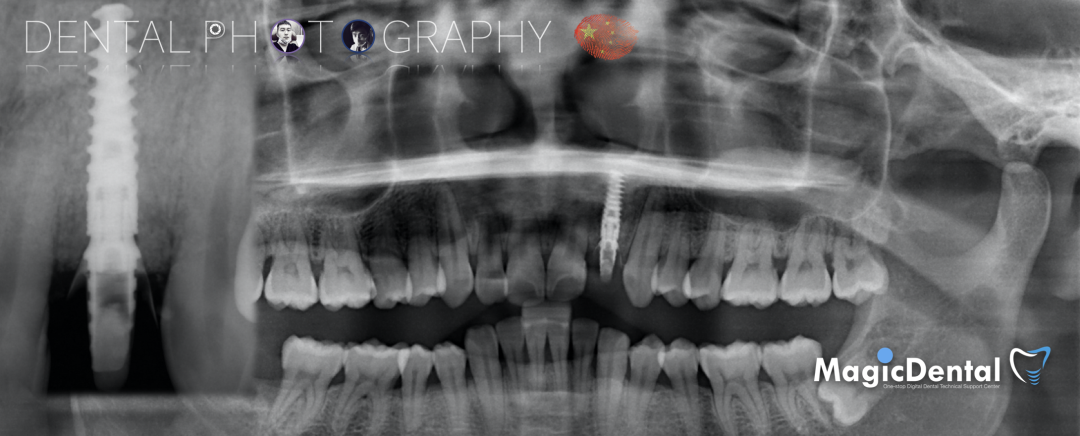
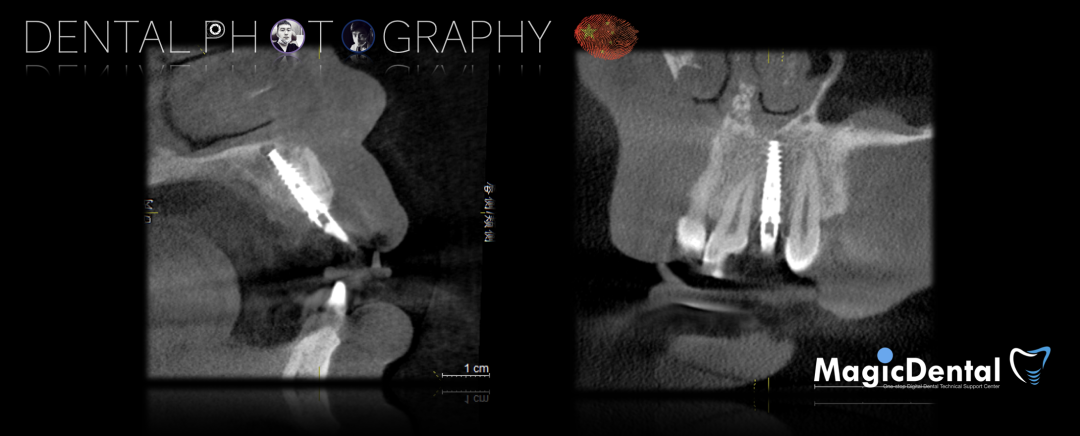
术后3个月CBCT及X线片。

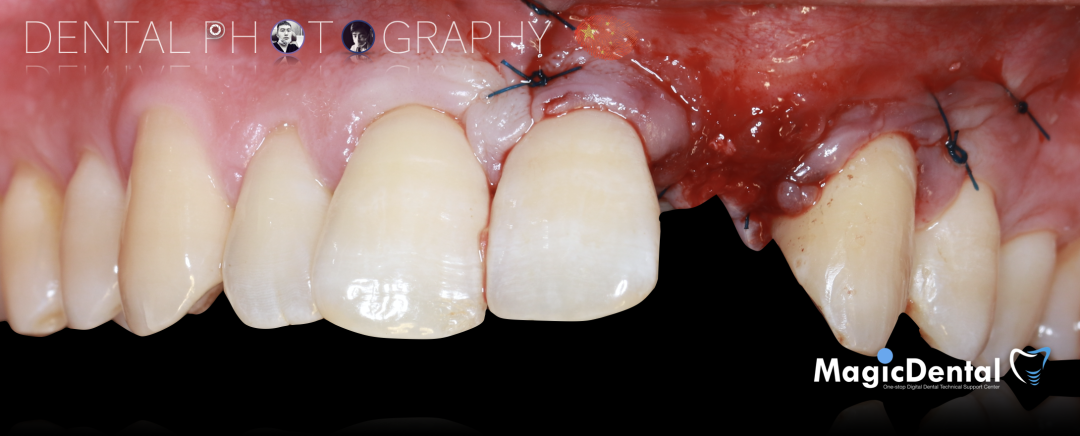
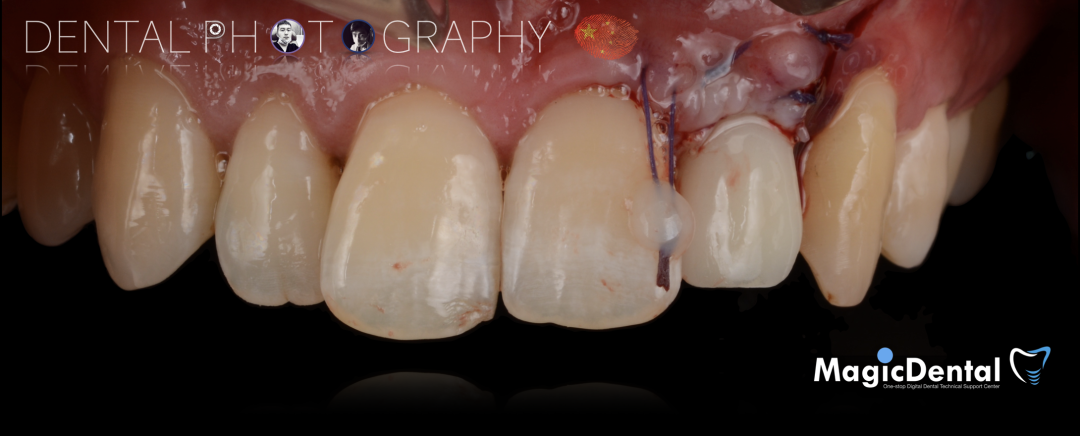
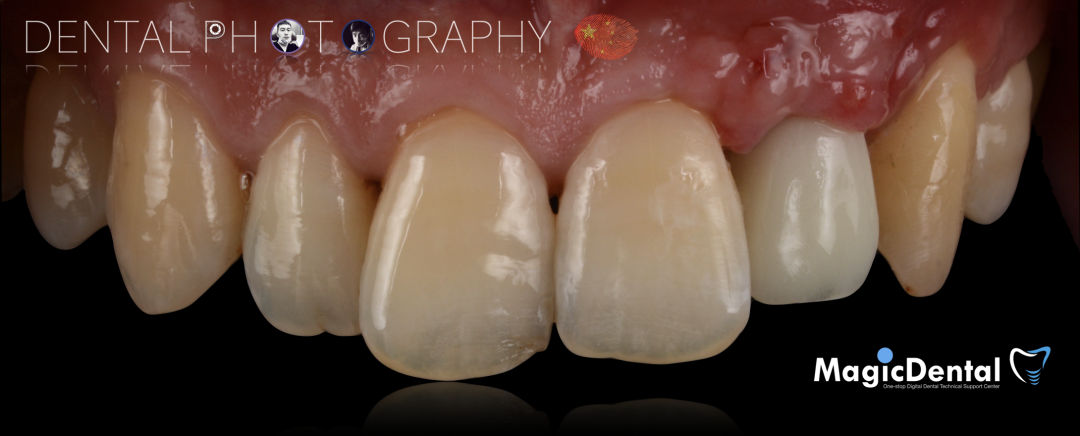
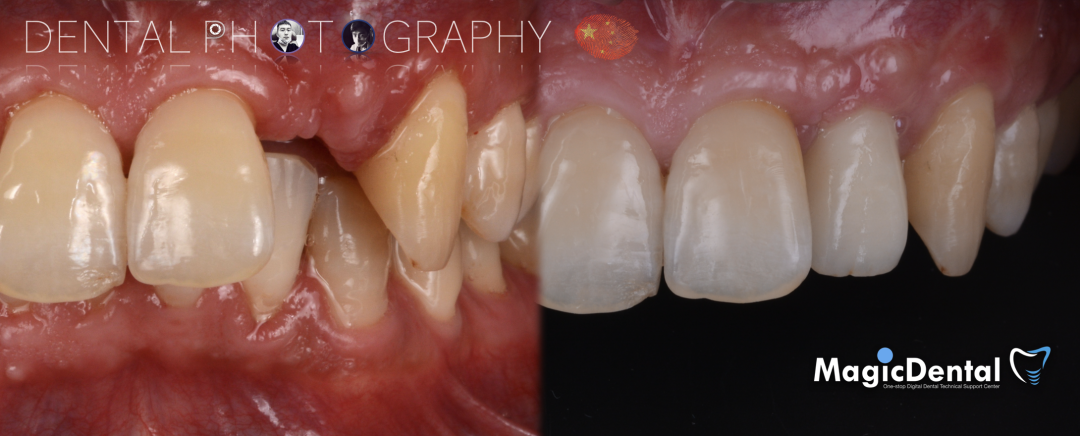
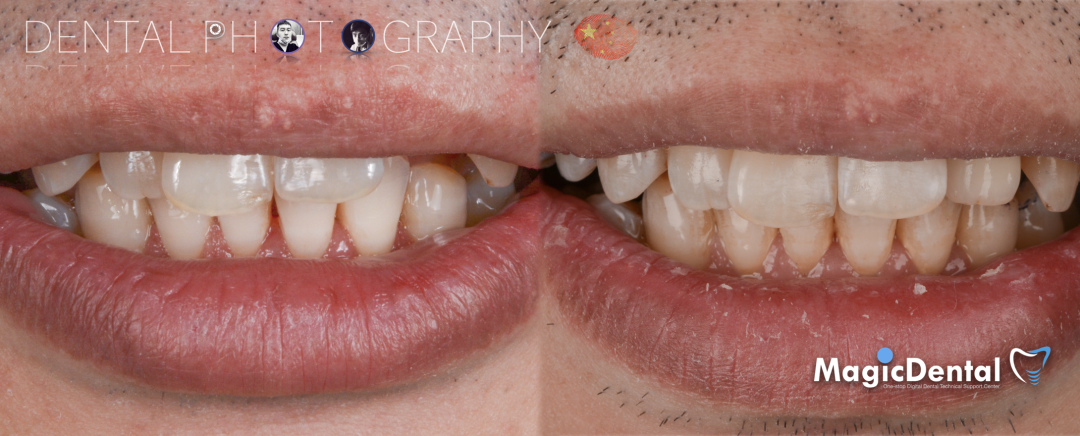
术后三个月口内正面像

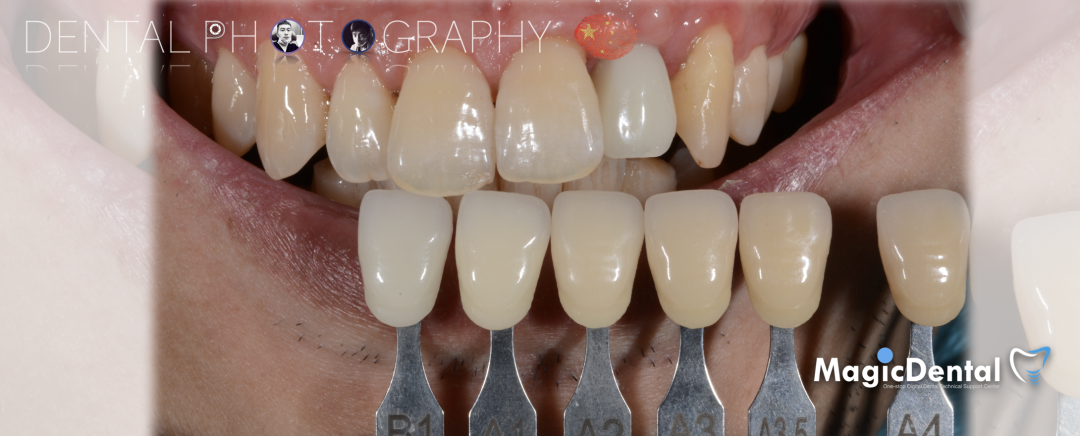



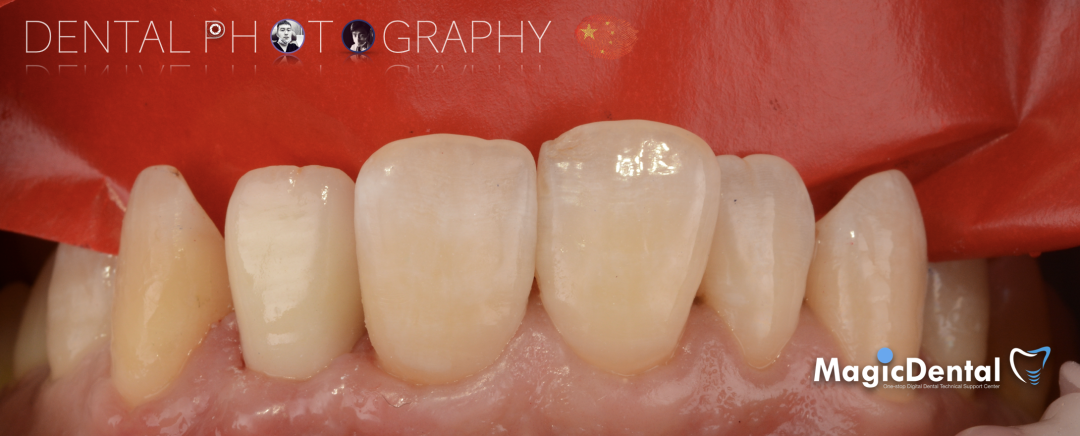

术前术后对比
参考文献:
1. Brånemark PI, Lindstro J, Hallen O, Breine U, Jeppson PH, Ohman A. Reconstruction of the defective mandible. Scand J Plast Reconstr Surg 1975; 9:116–128.
2. Misch CM. Ridge augmentation using mandibular ramus bone grafts for the placement of dental implants: presenta- tion of a technique. Pract Periodontics Aesthet Dent 1996;8:127–135.
3. Nystrom E, Ahlqvist J, Gunne J, Kahnberg KE. 10-year follow-up of onlay bone grafts and implants in severely resorbed maxillae. Int J Oral Maxillofac Surg 2004; 33:258– 262.
4. Nyström E, Nilson H, Gunne J, Lundgren S. A 9–14 year follow-up of onlay bone grafting in the atrophic maxilla. Int J Oral Maxillofac Implants 2009; 38:111–116.
5. Dimitriou1 E, Jones E, McGonagle D, Giannoudis PV. Bone regeneration: current concepts and future directions. BMC Med 2011; 9:66–76.
6. Clementini M, Morlupi A, Agrestini S, Ottria L. Success rate of dental implants inserted in autologous bone graft regen- erated area: a systemic review. Oral Implantol 2012; 4:3–10.
7. Zouhary KJ. Bone graft harvesting from distant sites: con- cepts and techniques. Oral Maxillofac Surg Clin North Am 2010; 22:301–316.
8. Misch CM, Misch CE, Resnik RR, Ismail YH. Reconstruction of maxillary alveolar defects with mandibular symphysis grafts for dental implants: a preliminary procedural report. Int J Oral Maxillofac Implants 1992; 7:360–366.
9. Montazem A, Valauri DV, St-Hilaire H, Buchbinder D. The mandibular symphysis as a donor site in maxillofacial bone grafting: a quantitative anatomic study. J Oral Maxillofac Surg 2000; 58:1368–1371. 10. Proussaefs P, Lozada J, Kleinman A, Rohrer MD. The use of ramus autogenous block grafts for vertical alveolar ridge augmentation and implant placement: a pilot study. Int J Oral Maxillofac Implants 2002; 17:238–248.
11. Aalam AA, Nowzari H. Mandibular cortical bone grafts. Part 1: anatomy, healing process, and influencing factors. Compend Contin Educ Dent 2007; 28:206–212.
12. Schwartz-Arad D, Levin L. Multitier technique for bone aug- mentation using intraoral autogenous bone blocks. Implant Dent 2007; 16:5–12.
13. Schwartz-Arad D, Levin L. Symphysis revisited: clinical and histological evaluation of newly formed bone and reharvesting potential of previously used symphysial donor sites for onlay bone grafting. J Periodontol 2009; 80:865–869.
14. Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasma: growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85:638–646.
15. Marx RE. Platelet-rich plasma: evidence to support its use. J Oral Maxillofac Surg 2004; 62:489–496.
16. Nauth A, Giannoudis PV, Einhorn TA, et al. Growth factors: beyond bone morphogenetic proteins. J Orthop Trauma 2010; 24:543–546.
17. Anitua E, Tejero R, Zalduendo MM, Orive G. Plasma rich in growth factors promotes bone tissue regeneration by stimu- lating proliferation, migration and autocrine secretion in primary human osteoblasta. J Periodontol 2013; 84:1180– 1190.
18. Gao C, Harvey EG, Chua M, et al. MSC-seeded dense colla- gen scaffolds with a bolus dose of VEGF promote healing of large bone defects. Euro Cell Mater 2013; 26:195–207.
19. Del Fabbro M, Bortolin M, Taschieri S. Is autologous platelet concentrate beneficial for post-extraction socket healing? A systematic review. Int J Oral Maxillofac Surg 2011; 40:891– 900.
20. Hatakeyama I, Marukawa E, Takahashi Y, Omura K. Effects of platelet-poor plasma, platelet-rich plasma, and platelet- rich fibrin on healing of extraction sockets with buccal dehiscence in dogs. Tissue Eng Part A 2013; 20(3–4):874– 882.
21. Yilmaz S, Kabadayi C, Ipci SD, Cakar G, Kuru B. Treatment of intrabony periodontal defects with platelet-rich plasma versus platelet-poor plasma combined with a bovine-derived xenograft: a control clinical trial. J Periodontol 2001; 82:837– 844.
22. Clark RF. Fibrin and wound healing. Ann N Y Acad Sci 2001;936:355–367.
23. Knox S, Crooks S, Rimmer CS. Role of fibronectin in the migration of fibroblasts into plasma clots. J Cell Biol 1986;102:2318–2323.
24. Brown F, Lanir J, McDonagh J, Tognazzi K, Dvorak AM, Dvorak HF. Fibroblast migration in fibrin gel matrices. Am J Pathol 1993; 142:273–283.

-END-
声明:本文转载自<DentalMagic>,仅用于学习交流,如有侵权,请立即联系我们处理。内容仅代表作者个人观点,望大家理性判断及应用。














