摘要
原发性骨内癌(PIOC)是颌骨罕见恶性肿瘤,临床易被误诊为牙源性囊肿或骨髓炎。本文报道1例53岁女性患者,初始因左下第三磨牙冠周炎继发下颌骨骨髓炎就诊。患者于全麻下行患牙拔除术,拔牙窝内肉芽组织送病理检查提示中分化鳞状细胞癌。术后影像学检查显示下颌骨明显吸收破坏,肿瘤侵犯下颌管并紧邻左侧下颌下淋巴结。综合诊断为原发性骨内癌,随后行左侧颈淋巴结清扫术、下颌骨半切术及重建术。病理检查确认诊断,未发现淋巴结转移。术后7年4个月随访,患者无肿瘤复发。PIOC多源于牙源性囊肿,因病变位于骨内常晚期发现。其诊断需满足与口腔黏膜无连续性、无口腔转移瘤且存在鳞状细胞癌成分。早期诊断与治疗对改善患者预后及生活质量至关重要。本例提示,对于破坏性骨吸收病例需警惕恶性肿瘤可能,及时活检可避免延误治疗。
引言
原发性骨内癌(PIOC)是罕见恶性肿瘤,核心诊断标准包括颌骨中心性破坏病变、与表面黏膜或上颌窦无交通、排除转移癌。既往研究显示,PIOC好发于男性(占69.3%),平均发病年龄57.3岁(范围5-89岁),解剖上以下颌骨多见(下颌骨与上颌骨比例7:1),且多位于下颌骨后份。影像学表现中,31.1%病例为边界不清的不规则病灶,33.5%伴皮质骨破坏。根据世界卫生组织头颈部肿瘤分类,PIOC未特指型(NOS)主要为不同分化程度的鳞状细胞癌,以中分化最常见。研究表明,多数病例源于牙源性囊肿,其中残余囊肿和根尖囊肿最常见,其次为含牙囊肿和牙源性角化囊肿。2022年WHO分类将其归为“牙源性肿瘤”大类下的“恶性牙源性肿瘤”。口腔内PIOC的严格诊断具有挑战性,需与恶性牙源性肿瘤(如成釉细胞癌、透明细胞牙源性癌、幽灵细胞牙源性癌)、骨内唾液腺肿瘤(如黏液表皮样癌)、转移瘤、炎症性病变及邻近结构继发侵犯骨的癌肿相鉴别。若同时存在皮质骨破坏及邻近软组织病损(如溃疡),则无法与口腔黏膜来源恶性肿瘤区分。
本文报道1例初始误诊为阻生左下第三磨牙冠周炎继发下颌骨骨髓炎的PIOC病例,最终通过拔牙窝周围肉芽组织病理检查修正诊断为PIOC。
病例报告
2017年3月,一名53岁女性因左下第三磨牙区疼痛就诊于当地牙科诊所,临床诊断为左下第三磨牙冠周炎,转诊至我科拟行拔牙术。初诊时,患者口外检查未见异常;口内检查见左下磨牙区牙龈红肿,左下第三磨牙(38)完全阻生。曲面体层片显示36、37牙根尖区可见少许低密度影,但38周围无明显异常(图1)。
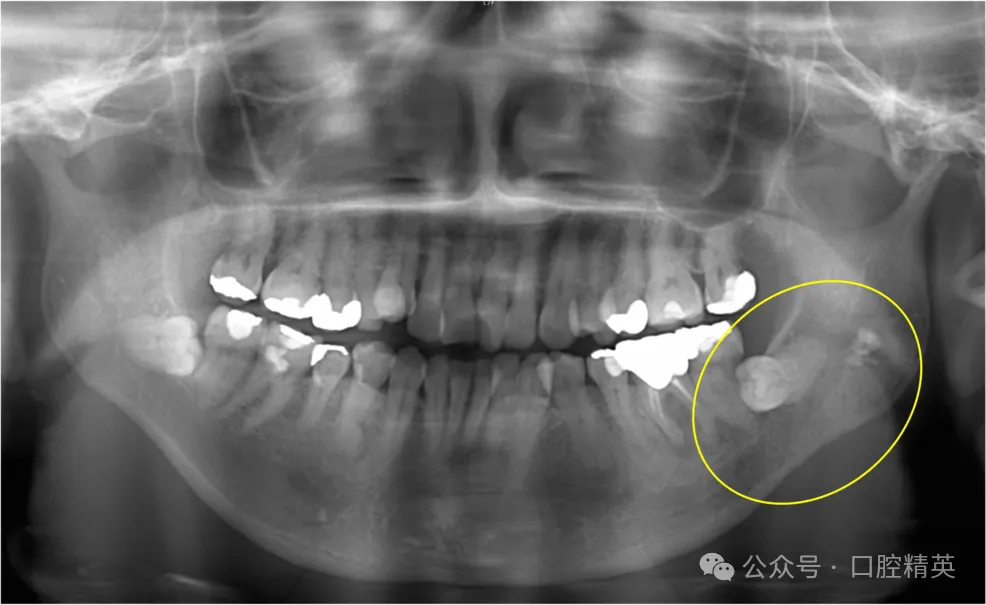
图1 初诊曲面体层片
可见36、37根尖区少许低密度影,38周围无显著异常(黄圈所示)。
进一步CT检查显示,36、37及38周围舌侧骨皮质存在不规则吸收(图2)。
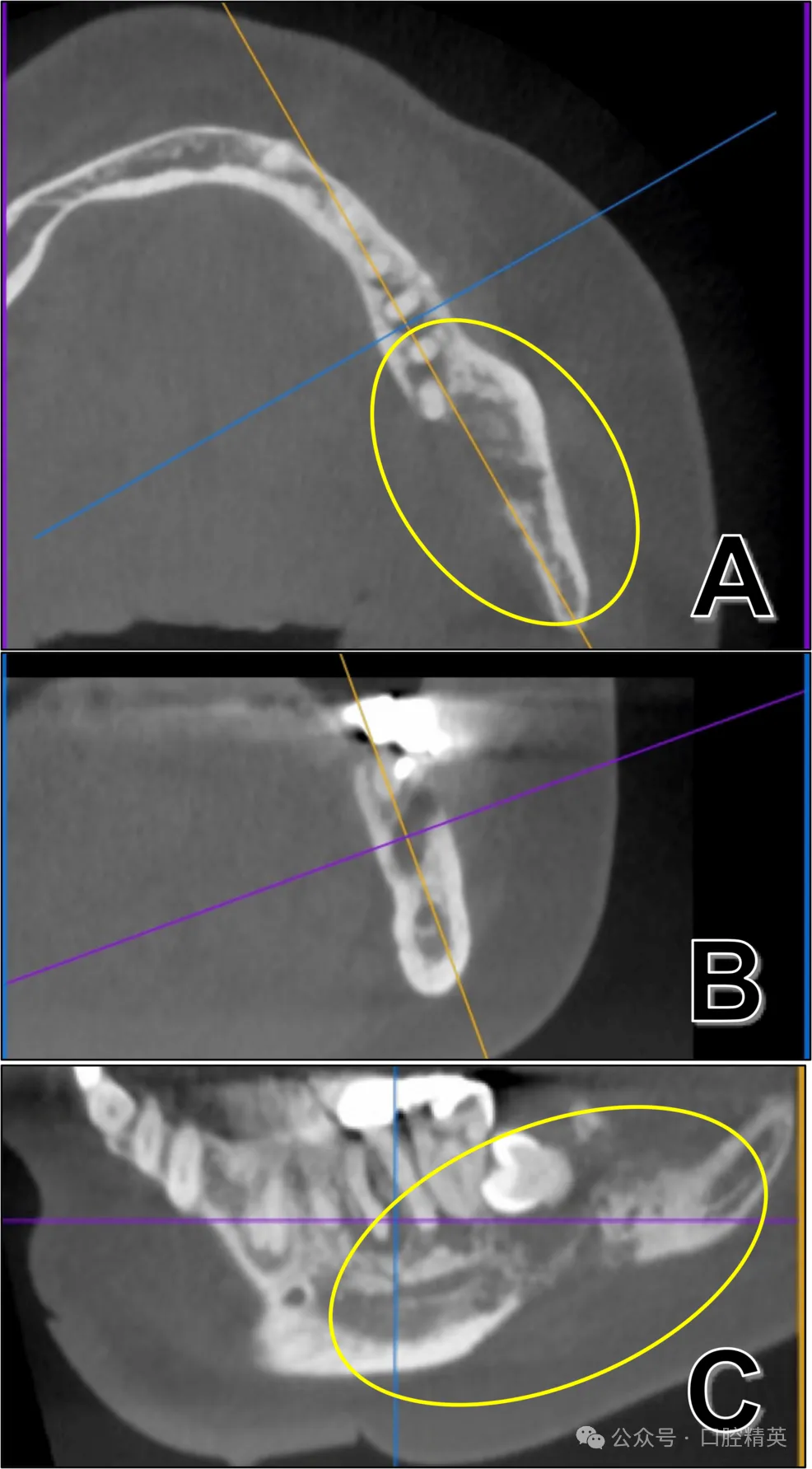
图2 初诊CT影像
36-38区域轴位(A)、冠状位(B)、矢状位(C)影像可见舌侧骨皮质不规则吸收(黄圈示骨皮质破坏关键表现)。
结合病史及检查,初步临床诊断为38冠周炎继发下颌骨骨髓炎,于2017年7月在全身麻醉下行拔牙术。鉴于术前CT提示骨破坏性吸收,需警惕恶性病变可能,遂将拔牙窝周围肉芽组织送组织病理学检查。结果显示:肉芽组织中见散在上皮巢,伴角化及核深染、非典型核分裂等细胞异型性,最终诊断为中分化鳞状细胞癌(图3)。
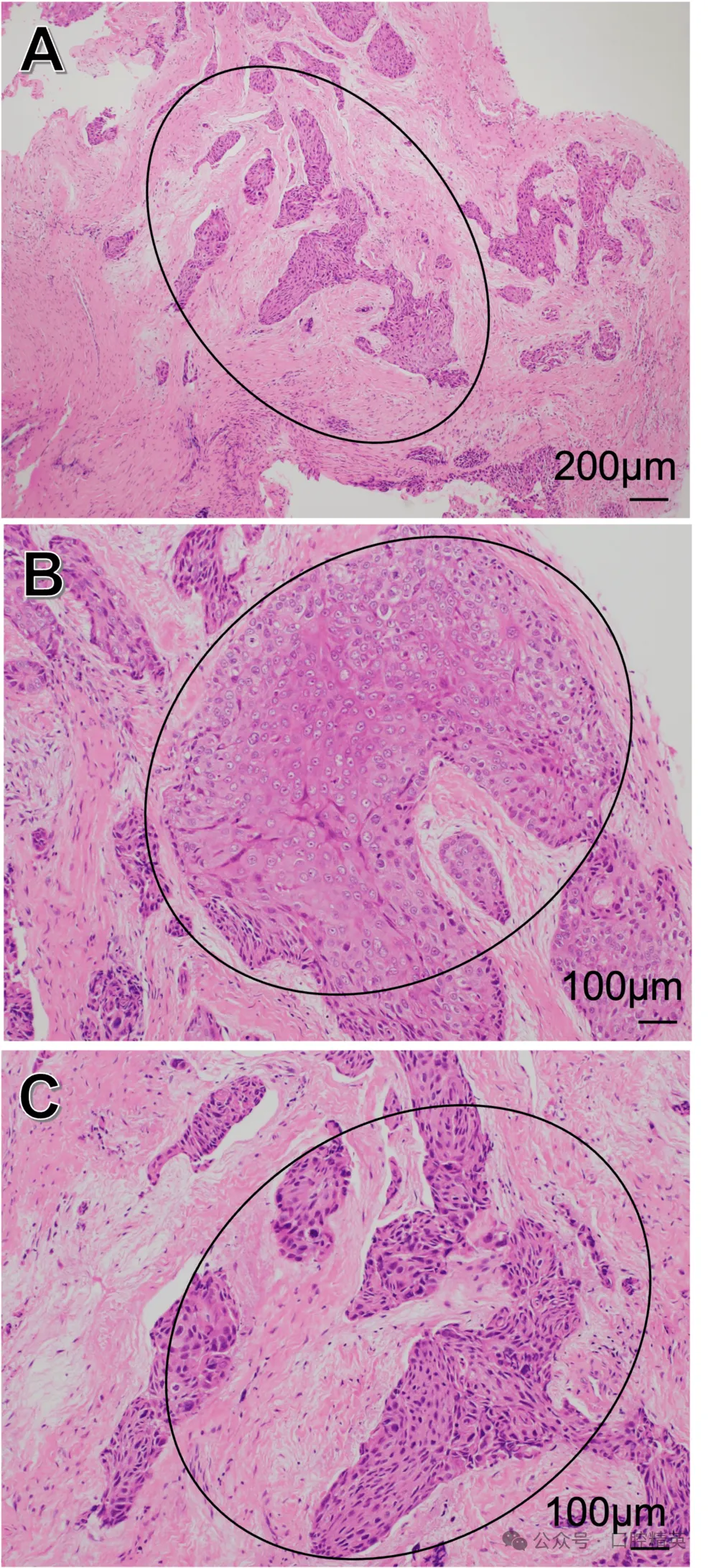
图3 拔牙窝肉芽组织组织学表现
(A)肉芽组织中散在上皮巢;(B)可见角化;(C)可见核深染、非典型核分裂等细胞异型性(黑圈示拔牙窝肉芽组织中检出鳞状细胞癌)。
术后曲面体层片显示,38邻近区域及下颌骨下缘骨吸收显著(图4)。
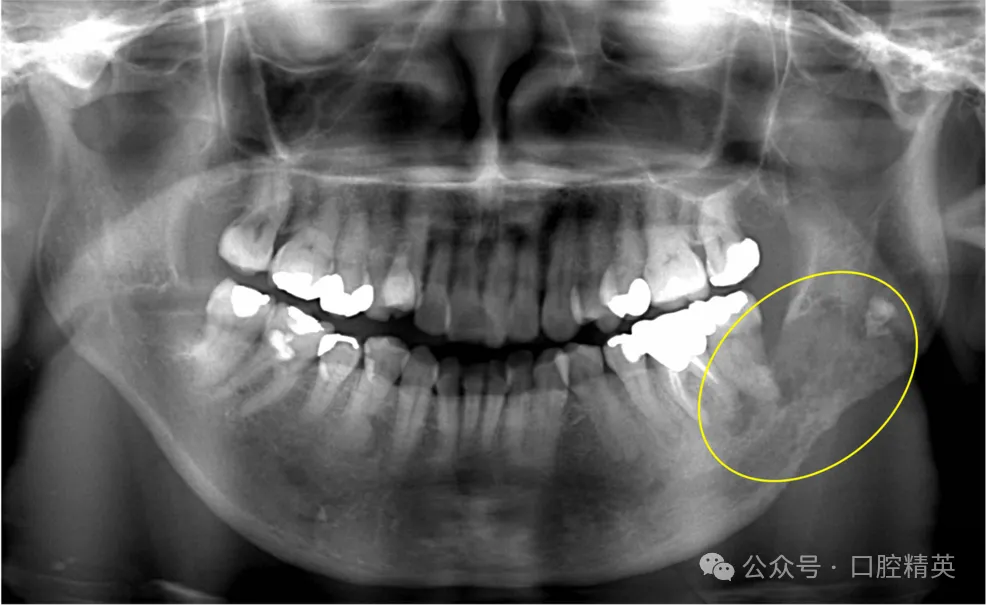
图4 38拔牙后曲面体层片
可见38邻近区域及下颌骨下缘明显骨吸收(黄圈示较术前骨破坏进展,提示非典型下颌骨骨髓炎)。
CT进一步证实舌侧骨皮质吸收并侵犯下颌管(图5)。
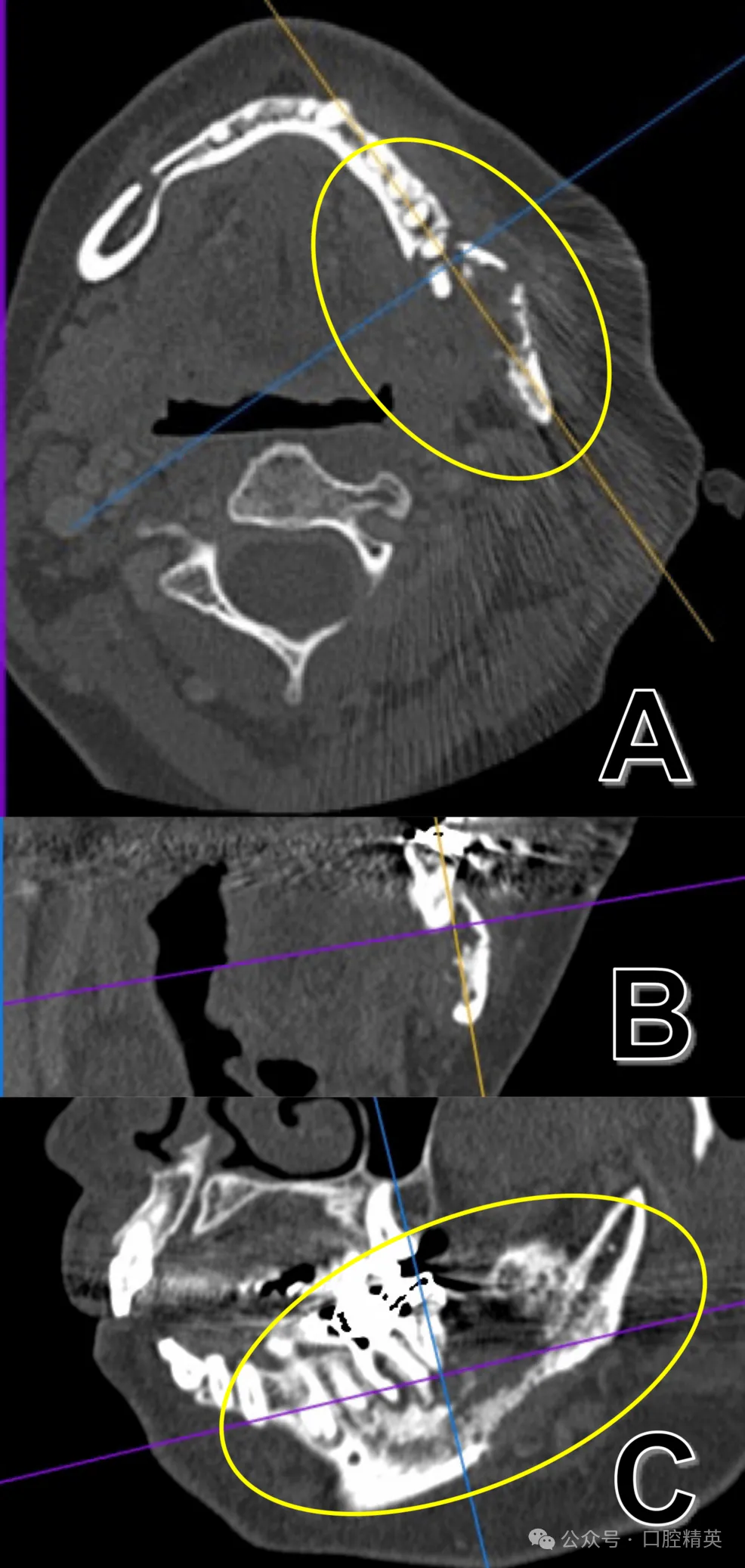
图5 38拔牙后CT(硬组织模式)
(A)、冠状位(B)、矢状位(C)影像可见舌侧骨皮质不规则破坏性吸收并侵犯下颌管(黄圈示较术前舌侧骨皮质破坏进展)。
此外,病灶与左侧下颌下淋巴结关系密切,提示存在淋巴结直接侵犯可能(图6)。
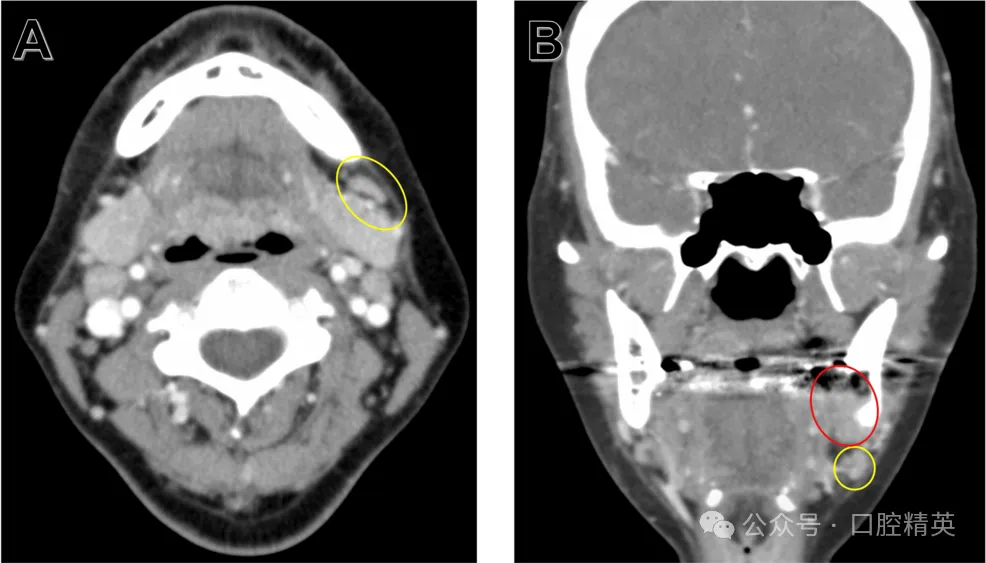
图6:38牙拔除术后计算机断层扫描(软组织模式)
(A)及轴位(B)影像显示,病变(红色椭圆)与左侧下颌下淋巴结(黄色椭圆)关系密切,提示存在淋巴结直接侵犯可能。
增强磁共振成像(MRI)显示,38牙拔牙窝至下颌支区域可见早期强化肿块,侵犯翼下颌间隙,符合恶性肿瘤表现(图7)。
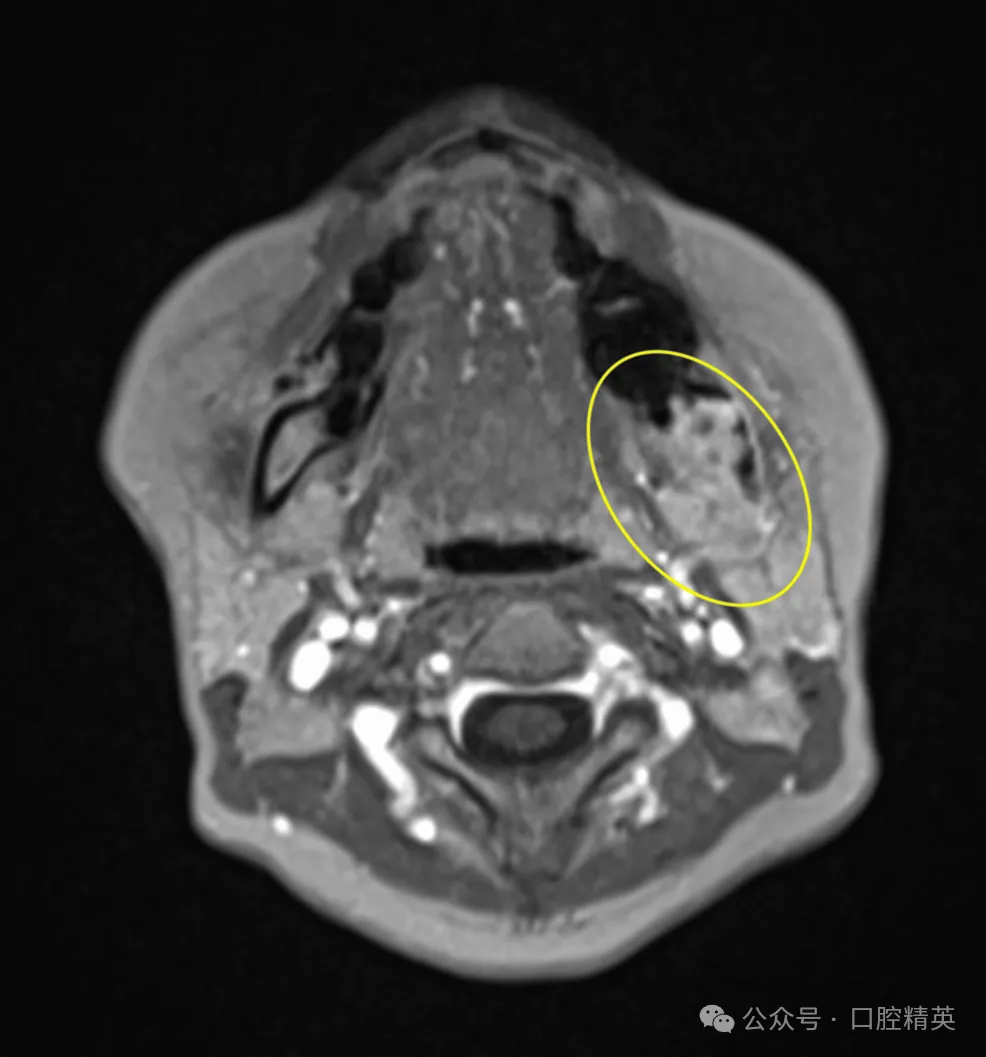
图7:增强磁共振成像
增强磁共振成像显示,38牙拔牙窝至下颌支区域可见早期强化肿块,侵犯翼下颌间隙,符合恶性肿瘤表现(黄色椭圆:高度提示恶性)。
超声检查未发现颈部淋巴结转移征象。氟代脱氧葡萄糖F18正电子发射断层扫描(PET)显示,拔牙窝至左侧下颌支区域肿块呈高摄取(图8),未发现提示远处转移的异常摄取。
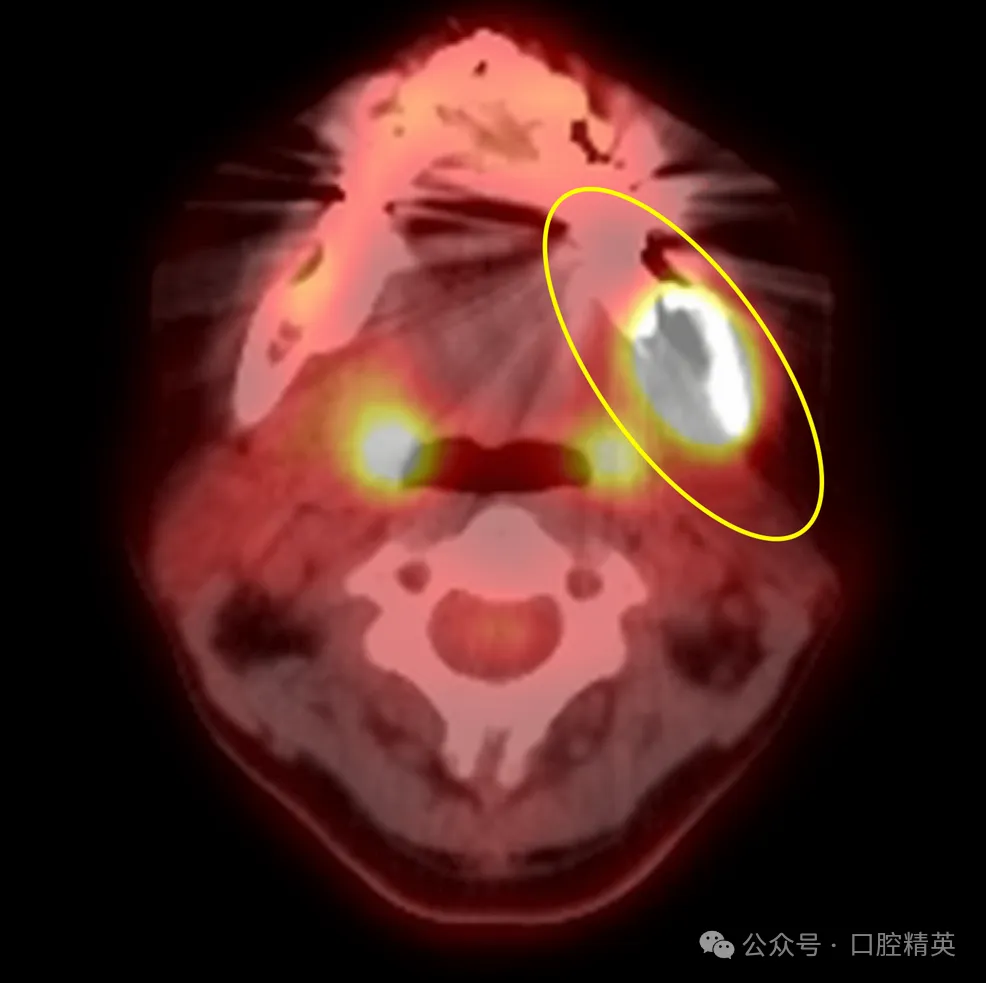
图8:38牙拔除术后氟代脱氧葡萄糖F18正电子发射断层扫描
氟代脱氧葡萄糖F18正电子发射断层扫描显示,拔牙窝至左侧下颌支区域肿块呈高摄取(黄色椭圆:高度提示恶性)。
结合上述检查结果,患者被诊断为原发性骨内癌(PIOC),并于2017年8月接受左侧颈淋巴结清扫术、左侧半下颌骨切除术,并行钛板联合腹直肌游离皮瓣修复(图9)。
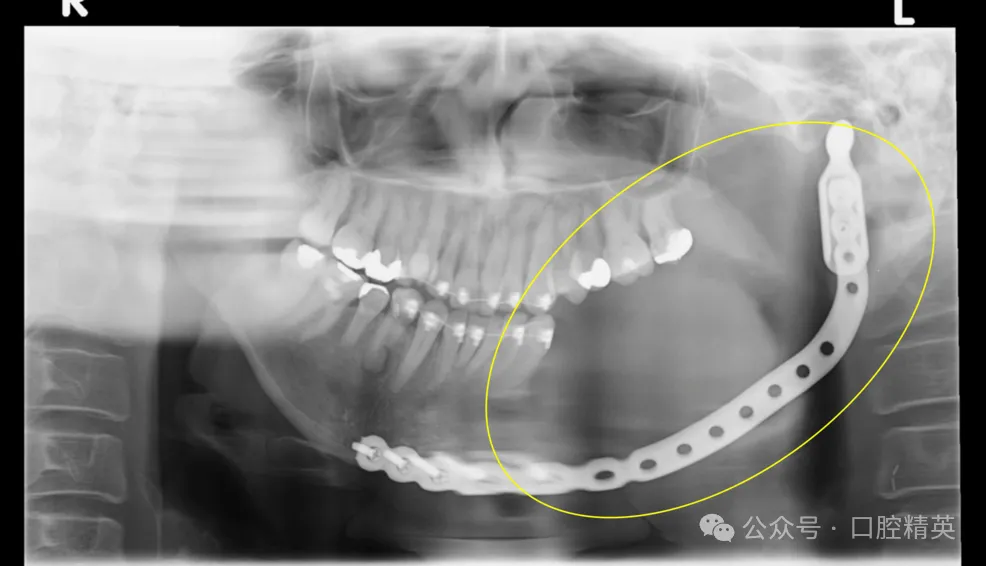
图9:术后全景片(黄色椭圆:病变区域已完整切除)
手术标本组织病理学检查未见淋巴结转移。镜下可见癌巢呈骨内生长,与表面上皮无连续性;表面上皮细胞角蛋白19(CK19)阴性,侵犯下牙槽神经的癌巢CK19阳性,提示为牙源性上皮来源,最终诊断为原发性骨内癌(未特指型,PIOC)(图10)。
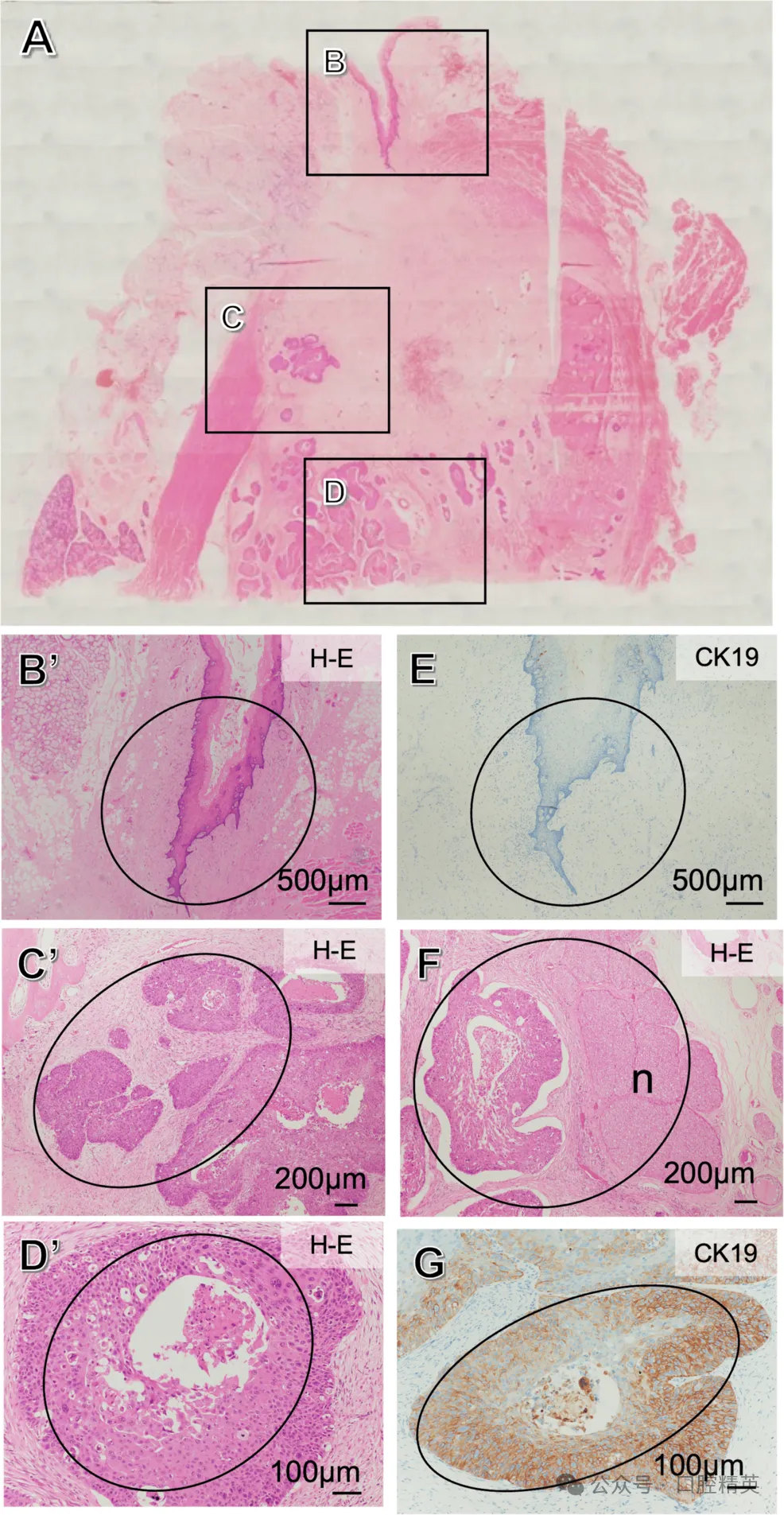
图10:手术标本组织学检查
(A);确认癌巢呈骨内生长,与表面上皮无连续性(B-D),B、C、D的高倍放大图分别对应B’、C’、D’;表面上皮CK19阴性(E),侵犯下牙槽神经(n)的癌巢可见(F)且CK19阳性(G)(黑色椭圆:黏膜上皮正常,但颌骨内可见鳞状细胞癌,此表现明确提示为原发性骨内癌)。
术后7年4个月,患者一般状况良好,无原发灶复发、颈部复发及远处转移。
讨论
本文报道1例罕见的下颌骨原发性颌骨内鳞状细胞癌(PIOC),其最初因左下第三磨牙冠周炎被误诊为下颌骨骨髓炎,旨在强调其诊断难点及早期发现的重要性。
PIOC属于罕见恶性牙源性肿瘤,占所有牙源性癌的1%-2.5%,约占口腔鳞状细胞癌的2%。好发于50岁末年龄段人群,男女比例约2:1,男性更常见。因病变起源于颌骨内,常以牙痛为首发症状。
PIOC的诊断需满足:与口腔黏膜无连续性、无口腔转移性肿瘤、存在鳞状细胞癌成分。影像学鉴别诊断存在挑战,因其常与根尖囊肿或其他牙源性囊肿表现相似。研究显示,PIOC可能起源于残余囊肿(60%)、含牙囊肿(16%)、牙源性角化囊肿(14%)或侧方牙周囊肿(1%)。
本例中,拔牙窝肉芽组织的组织病理学检查确诊为鳞状细胞癌,但癌细胞确切来源不明。推测其可能源于冠周炎刺激增殖的牙源性残余上皮,或左下第三磨牙周围的缩余釉上皮。与口腔黏膜来源的鳞状细胞癌不同,PIOC可导致颌骨破坏性吸收,因此初始手术常需行下颌骨节段性切除术或半侧下颌骨切除术。有文献报道下颌区肿瘤可直接侵犯邻近颈淋巴结,提示存在局部扩散风险。结合本例肿瘤与颈淋巴结位置邻近,在原发灶切除的同时实施了颈淋巴结清扫术,以全面控制病变并评估淋巴转移情况。
既往有类似病例报告显示,PIOC最初可表现为下第三磨牙根尖周病变的影像学特征,导致患牙拔除。部分病例中,拔牙创后续被误认为骨髓炎或愈合延迟,可能延误明确诊断及规范治疗。本例病变最初表现为下颌骨骨髓炎,同样面临诊断挑战。鉴于其复杂性,对影像学可疑病变进行全面评估对实现及时准确诊断至关重要。
为提高早期检出率并减少治疗延误,对疑似PIOC病例应重点考虑增强CT及增强MRI检查。此外,PET-CT在检测代谢活性增高的恶性病变中效能显著,可为综合评估提供更多信息。这些影像手段可清晰显示肿瘤范围、皮质骨受累情况及潜在转移,有助于优化术前规划并改善患者预后。
目前尚无针对PIOC的标准化治疗方案。但有研究指出,其总生存率(OS)与IV期口腔鳞状细胞癌相近,可参考T3N0期口腔癌的治疗策略。未来需进一步研究以制定标准化治疗方案,从而提高PIOC患者生存率。
既往研究显示,单因素分析中术后辅助治疗可改善生存率,但多因素分析未将其识别为独立预后因素,仅淋巴结阳性状态、高组织学分级及N分期进展是生存的显著预测指标。本例未出现上述任一不良预后因素,故支持不实施术后辅助治疗的决策。另有研究报道,原发性骨内鳞状细胞癌(PIOC)2年总生存率为61.3%,且无淋巴结转移是关键预后因素,这或可解释本例良好的长期预后。
组织病理学检测显示,CK19阳性结果证实骨内病变来源于牙源性上皮,而黏膜上皮CK19阴性,支持PIOC(未特指型)诊断。受限于现有组织样本,未能完成所有牙源性恶性肿瘤的全面免疫组化检测。但本例缺乏成釉细胞瘤的典型组织学特征(如周边栅栏状排列、极性倒置及星网状结构样表现),故可排除成釉细胞癌。未来需通过更广泛的免疫组化标记物检测,进一步提高牙源性恶性肿瘤的诊断准确性并阐明其分子特征。
目前,由于对PIOC生物学行为的认知有限,尚未建立区分PIOC与传统鳞状细胞癌的可靠生物标志物,需进一步研究其分子差异以提升诊断准确性,这仍是未来重要研究方向。
结论
本例因拔牙时即考虑恶性可能并实施活检,避免了治疗延迟,且提前预估了后续手术方案。PIOC预后较差,其原因常与初期误诊为牙源性囊肿、牙源性肿瘤或下颌骨骨髓炎导致的诊疗延迟相关。鉴于其不良预后,早期诊断与及时治疗对改善患者生活质量及总体预后至关重要。承担初步评估的全科医生及口腔外科医生需提高警惕,对放射学表现可疑的牙源性病变应考虑恶性可能,完善影像与临床评估以保障精准诊疗。
-END-
声明:本文转载自<口腔精英>,仅用于学习交流,如有侵权,请立即联系我们处理。内容仅代表作者个人观点,望大家理性判断及应用。














